कोलेजन

कोलेजन एक स्वाभाविक रूप से पाए जाने वाले प्रोटीन का समूह है। प्रकृति में, यह जानवरों में विशेष रूप से पाया जाता है।[1] यह संयोजी ऊतक का मुख्य प्रोटीन है। यह स्तनपायियों में प्रचुर मात्रा में पाया जाने वाला प्रोटीन है,[2] जो समग्र-शरीर की प्रोटीन सामग्री का लगभग 25% से 35% अंश बनता है।
मांसपेशी ऊतक में यह एंडोमिशियम के एक प्रमुख घटक के रूप में कार्य करता है। मांसपेशी ऊतक का 1% से 2% कोलेजन से बना है और मज़बूत, कंडरीय मांसपेशियों के वज़न का 6% इससे गठित है।[3] जिलेटिन, जिसका खाद्य और उद्योग में प्रयोग किया जाता है, कोलेजन से व्युत्पन्न है।
इतिहास और पृष्ठभूमि
कोलेजन की आण्विक और पैकिंग संरचनाओं को दशकों तक वैज्ञानिक समझ नहीं पाए; 1930 दशक के मध्य में पहला प्रमाण प्रस्तुत किया गया कि आण्विक स्तर पर इनकी नियमित संरचना है।[4][5] उस समय से कई प्रमुख विद्वान, जिनमें शामिल हैं (पर इस तक ही सीमित नहीं) नोबेल पुरस्कार विजेता क्रिक, पॉलिंग, रिच, योनाथ, ब्रॉडस्की, बर्मन और रामचंद्रन जिन्होंने कोलेजन एकलक की रचना पर ध्यान केंद्रित किया। कई प्रतियोगी मॉडलों ने बहरहाल प्रत्येक पेप्टाइड श्रृंखला की रचना के संबंध में सही ढंग से व्यवहृत करते हुए, त्रिविध-सर्पिल "मद्रास" मॉडल का मार्ग प्रशस्त किया, जिसने लगभग सही आण्विक चतुष्क संरचना[6][7][8] उपलब्ध कराया, हालांकि इस मॉडल में अभी भी कुछ शोधन अपेक्षित थे[9][10][11][12]. कोलेजन की पैकिंग संरचना को तंतुमय कोलेजन प्रकारों के बाहर उसी मात्रा तक परिभाषित नहीं किया गया, हालांकि लंबे समय से उसके षड्भुजाकार या अर्ध-षड्भुजाकार होने की बात ज्ञात थी[13][14][15]. उसकी एकलक संरचना के समान ही, कई परस्पर विरोधी मॉडलों ने निर्दिष्ट किया कि कोलेजन अणुओं की पैंकिंग व्यवस्था या तो 'चादर की तरह' है या सूक्ष्मतंतुमय.[16][17] हाल ही में यह पुष्टि की गई कि फ्रेज़र, मिलर, वेस (अन्य लोगों के साथ-साथ) द्वारा वर्णित सूक्ष्मतंतुमय संरचना, प्रेक्षित संरचना के सबसे करीब थी, यद्यपि उसने निकटस्थ कोलेजन अणुओं की सांस्थितिक प्रगति को अति सरल बना दिया था और इसलिए असतत डी-आवधिक पंचतयी व्यवस्था, जिसे आसानी से कहें तो: सूक्ष्मतंतु की संरचना का सही पूर्वानुमान नहीं लगा सका। [18]
आण्विक संरचना
ट्रोपोकोलेजन या "कोलेजन अणु", तंतु जैसे बड़े कोलेजन समुच्चय की उप-इकाई है। यह लगभग 300 nm और लंबे और 1.5 nm व्यास के, तीन पॉलीपेप्टाइड रेशों (जो अल्फ़ा श्रृंखलाएं कहलाते हैं) का बना है, जहां प्रत्येक में बाएं हाथ की सर्पिल रचना शामिल है (इसके नाम को आम दाएं हाथ की संरचना, अल्फ़ा हेलिक्स से भ्रमित नहीं होना चाहिए). ये तीन बाएं हाथ के सर्पिलों को दाएं हाथ के कुंडलित कॉइल, एक ट्रिपल हेलिक्स या "सुपर हेलिक्स", कई हाइड्रोजन बांड द्वारा दृढ़ीकृत सहयोगी चतुष्क संरचना में साथ मरोड़ा जाता है। टाइप I कोलेजन के साथ और सभी कोलेजन नहीं तो, संभवतः सभी तंतुमय कोलेजन, प्रत्येक ट्रिपल-हेलिक्स दाएं हाथ के सुपर-सुपर-कॉइल में संबद्ध होता है, जिसे कोलेजन सूक्ष्मतंतु के रूप में सन्दर्भित किया जाता है। प्रत्येक सूक्ष्मतंतु अपने निकटतम सूक्ष्मतंतु के साथ इस मात्रा तक एकांतरित होता है कि लगता है वे व्यक्तिगत रूप से अस्थिर रहे हों हालांकि कोलेजेन तंतुओं के भीतर वे स्फटिक के समान, अच्छी तरह से व्यवस्थित होते हैं।
कोलेजन की एक सुस्पष्ट विशेषता है इन कोलेजन उप-इकाइयों की तीन श्रृंखलाओं में प्रत्येक में एमिनो एसिड की नियमित व्यवस्था। अनुक्रम अक्सर Gly-Pro-Y या Gly-X-Hyp के पैटर्न का अनुकरण करता है, जहां X और Y कोई अन्य विभिन्न एमिनो एसिड अवशेष हो सकते हैं। प्रोलाइन या हाइड्रॉक्सीप्रोलाइन कुल अनुक्रम का 1/6 गठित करते हैं। अनुक्रम का 1/3 ग्लाइसिन होते हुए, इसका मतलब है कि लगभग कोलेजन अनुक्रम का आधा भाग ग्लाइसिन, प्रोलाइन या हाइड्रॉक्सीप्रोलाइन नहीं है, एक तथ्य जो अक्सर कोलेजन अल्फा-पेप्टाइड्स के असामान्य GXY स्वभाव के विक्षेप के कारण ध्यान में नहीं रहता. इस तरह का नियमित दोहराव और उच्च ग्लाइसिन सामग्री केवल कुछ अन्य तंतुमय प्रोटीन में पाई जाती है, जैसे कि रेशमी फ़ाइब्राइन. रेशम का 75-80% (लगभग) 10% सेरिन और एलास्टिन के साथ -Gly-Ala-Gly-Ala- है जिसमें ग्लाइसिन, प्रोलाइन और एलनाइन (Ala) प्रचुर मात्रा में है, जिसका पार्श्व समूह छोटा निष्क्रिय मिथाइल समूह है। ऐसे उच्च ग्लाइसिन और नियमित दोहराव, अपने अनुक्रम के बहुत ही कम वर्गों के सिवाय, गोलाकार प्रोटीन में कभी नहीं पाए गए। संरचनात्मक प्रोटीनों में रासायनिक-प्रतिक्रियाशील पार्श्व समूहों की जरूरत नहीं रही है, चूंकि वे एंज़ाइमों और परिवहन प्रोटीनों में रहे हैं, तथापि कोलेजन सिर्फ़ एक संरचनात्मक प्रोटीन नहीं है। कोशिका फ़ीनोटाइप, कोशिका आसंजन, ऊतक विनियमन और बुनियादी ढांचे के निर्धारण में उसकी महत्वपूर्ण भूमिका के कारण, उसके कई गैर प्रोलाइन समृद्ध क्षेत्रों के कई वर्गों में कोशिका या मैट्रिक्स सहयोग / विनियमन भूमिकाएं मौजूद रहती है। प्रोलाइन और हाइड्रॉक्सीप्रोलाइन की अपेक्षाकृत उच्च सामग्री, उनके ज्यामितीय कृत्रिम कार्बाक्सिल और (माध्यमिक) एमीनो समूहों के साथ, ग्लाइसिन की समृद्ध मात्रा सहित, व्यक्तिगत पॉलीपेप्टाइड लड़ियों द्वारा बिना अंतःश्रृंखला हाइड्रोजन बांड के बिना, अनायास बाएं हाथ के हेलिक्स रचने के स्वभाव के कारक हैं।
क्योंकि ग्लाइसिन बिना पार्श्व-श्रृंखला के छोटी एमीनो एसिड है, यह तंतुमय संरचनात्मक प्रोटीन में एक अद्वितीय भूमिका निभाती है। कोलेजन में, हर तीसरे स्थान में Gly की ज़रूरत होती है, क्योंकि ट्रिपल हेलिक्स का संयोजन इस अवशेष को हेलिक्स के अंतरंग (अक्ष) में रखता है, जहां ग्लाइसिन के एकल हाइड्रोजन परमाणु के अलावा बड़े पार्श्व समूह के लिए कोई जगह नहीं है। इसी कारण से, Pro और Hyp के छल्ले बाहर की ओर निर्दिष्ट होने चाहिए। ये दो एमिनो एसिड ट्रिपल Pro की तुलना में हेलिक्स-Hyp की स्थिरता में मदद करते हैं—मछली जैसे प्राणियों में इनकी कम सांद्रता अपेक्षित है, जिनके शरीर का तापमान अधिकांश नियततापी प्राणियों से कम होता है।
तंतुमय संरचना
ट्रोपोकोलेजन उप-इकाइयां, नियमित टेढ़े-मेढ़े छोर के साथ, ऊतकों के कोशिकाबाह्य रिक्त स्थानों में और भी बड़े विन्यास में, अनायास स्वतः-संयोजित होती हैं।[19][20] तंतुमय कोलेजन में, अणु एक दूसरे से लगभग 67 nm (एक इकाई जिसे ‘D’ के रूप में सन्दर्भित किया जाता है और समुच्चय के जलयोजन दशा के आधार पर परिवर्तित होता है) विचलित होते हैं। प्रत्येक D-अवधि में 4 और कोलेजन अणुओं का एक अंश होता है। इसका कारण यह है कि 300 nm को 67 nm से विभाजित करने पर (कोलेजन अणु की लंबाई के विचलन दूरी D से विभाजन द्वारा) पूर्णांक नहीं मिलता है। अतः सूक्ष्मतंतु के प्रत्येक D-अवधि दोहराव पर, अनुप्रस्थ-काट में पांच अणुओं वाला हिस्सा होता है-जिसे "ओवरलैप" कहते हैं और "गैप" कहलाने वाला 4 अणुओं वाला हिस्सा होता है।[18] दोनों, गैप और ओवरलैप क्षेत्रों में, ट्रिपल हेलिक्स अनुप्रस्थ-काट में षड्भुजाकार या अर्ध-षड्भुजाकार विन्यास में व्यवस्थित होते हैं।[13][18].
ट्रिपल हेलिक्स के अंदर कुछ सहसंयोजक तिर्यक बंधन मौजूद हैं और सुव्यवस्थित समुच्चय (जैसे तंतु) गठित करने वाले ट्रोपोकोलेजन हिलक्स के बीच सहसंयोजक तिर्यक बंधन की अस्थिर मात्रा मौजूद है।[21] विभिन्न वर्ग के प्रोटीन (अलग प्रकार के कोलेजन सहित), ग्लाइकोप्रोटीन और प्रोटियोग्लाइकन की मदद से कई बड़े तंतुमय बंडलों का गठन होता है, जिससे उन्हीं प्रमुख क्रिया तत्वों के वैकल्पिक संयोजन से विभिन्न प्रकार के परिपक्व ऊतकों का गठन हो। [20] कोलेजन की अविलेयता एकलक कोलेजन के अध्ययन के लिए यह पाए जाने तक बाधा रही है कि छोटे पशुओं से ट्रोपोकोलेजन को निकाला जा सकता है क्योंकि वे अभी तक पूरी तरह तिर्यक बंधन में नहीं हैं। तथापि, माइक्रोस्कोपी तकनीक में उन्नति (इलेक्ट्रॉन माइक्रोस्कोपी (EM) और परमाणु शक्ति माइक्रोस्कोपी (AFM)) और एक्स-रे विवर्तन ने शोधकर्ताओं को स्वस्थानी कोलेजन संरचना के अधिक विस्तृत चित्र प्राप्त करने में सक्षम बनाया है। बाद की ये उन्नति यह समझने के लिए विशेष रूप से महत्वपूर्ण है कि कौन-सी कोलेजन संरचना कोशिका-कोशिका और कोशिका-मैट्रिक्स संप्रेषण को प्रभावित करती है तथा किस प्रकार वृद्धि और मरम्मत में ऊतकों का निर्माण और विकास तथा रोग में परिवर्तन होता है।[22][23]
कोलेजन तंतु, कोलेजन अणुओं के अर्द्ध क्रिस्टलीय समुच्चय होते हैं। कोलेजन रेशे तंतुओं के बंडल हैं।
कोलेजन तंतु/समुच्चय भिन्न ऊतक गुणों को उपलब्ध कराने के लिए विभिन्न ऊतकों के अलग-अलग संयोजन और सांद्रताओं में व्यवस्थित होते हैं। अस्थि में, संपूर्ण कोलेजन ट्रिपल हेलिक्स एक समानांतर, टेढ़े-मेढ़े विन्यास में पड़े रहते हैं। ट्रोपोकोलेजन उप-इकाइयों के सिरों पर 40 nm अंतराल (लगभग अंतर के क्षेत्र के बराबर) संभवतः खनिज घटक के लंबे, मज़बूत, महीन क्रिस्टल जमा करने के लिए केंद्रक स्थल का काम करते हैं, जोकि (लगभग) हाइड्रॉक्सियापटाइट, कुछ फ़ास्फ़ेट सहित Ca10(PO4)6(OH)2 है।
इस प्रकार कुछ तरह की उपास्थि हड्डी में बदल जाती हैं। टाइप I कोलेजन अस्थि को उसकी तन्य शक्ति प्रदान करता है।
प्रकार और संबंधित विकार
कोलेजन पूरे शरीर में कई स्थानों में होता है। अब तक, कोलेजन के 29 प्रकारों की पहचान की गई है और परिभाषित किया गया है। तथापि, शरीर में 90% से अधिक कोलेजन टाइप I, II, III और IV के होते हैं।
- कोलेजन एक: त्वचा, कंडरा, संवहनी, बंध, अंग, हड्डी (हड्डी के मुख्य घटक)
- कोलेजन दो: उपास्थि (उपास्थि का मुख्य घटक)
- कोलेजन तीन: जालीदार (जालीदार तंतुओं का मुख्य घटक), सामान्यतः टाइप I के साथ पाया जाता है।
- कोलेजन चार: कोशिका आधार झिल्ली का निचला भाग बनाता है
- कोलेजन पांच: कोशिकाओं की सतहें, बाल और गर्भनाल
कोलेजन से संबंधित रोग सबसे अधिक आनुवंशिक दोषों या पोषण संबंधी कमियों से उत्पन्न होते हैं जो जैव संश्लेषण, संयोजन, स्थानांतरणोत्तर संशोधन, स्राव, या सामान्य कोलाजेन उत्पादन में शामिल अन्य प्रक्रियाओं को प्रभावित करते हैं।
| प्रकार | नोट | जीन | विकार | - | I | यह मानव शरीर का सबसे प्रचुर कोलेजन है। यह क्षतचिह्न ऊतक में मौजूद होता है, अंतिम उत्पाद जब मरम्मत से ऊतक रोगमुक्त हो जाता है। यह कंडराएं, त्वचा, धमनी की दीवारें, पेशीतंतुओं के एंडोमाइशियम, तंतु-उपास्थि और हड्डी तथा दांत के जैविक हिस्से में पाया जाता है। | COL1A1, COL1A2 | अस्थिजनन अपूर्णता, एहलर्स-डैनलोस सिंड्रोम, शैशवकालीन मस्तिष्कप्रांतस्था अस्थि-ऊतक अतिवृद्धि उर्फ़ कैफ़ै रोग | - | II | स्फटिककला उपास्थि, संपूर्ण उपास्थि प्रोटीन का 50% बनाता है। आंख का काचाभ देहद्रव. | COL2A1 | [[कोलेजनोपथी, टाइप II और XI]] | - | III | यह कणांकुरण ऊतक का कोलेजन है और मज़बूत टाइप I कोलेजन के संश्लेषण से पहले शक्तिशाली तंतुप्रसुओं द्वारा शीघ्र उत्पादित किए जाते हैं। जालीदार रेशे. धमनी दीवारों, त्वचा, आंतों और गर्भाशय में भी पाए जाते हैं | COL3A1 | एहलर्स-डैनलोस सिंड्रोम | - | IV | आधारी पटल; नेत्र लेंस. इसके अलावा केशिकाओं की निस्पंदन प्रणाली और गुर्दे में वृक्कांग के केशिकागुच्छ के हिस्से रूप में कार्य करता है। | COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 | एलपोर्ट सिंड्रोम, गुडपास्चर सिंड्रोम | - | V | सबसे अंतरालीय ऊतक जो टाइप I से जुड़ा है, गर्भनाल से जुड़ा है। | COL5A1, COL5A2, COL5A3 | एहलर्स-डैनलोस सिंड्रोम (शास्त्रीय) | - | VI | सबसे अंतरालीय ऊतक, टाइप I से जुड़ा हुआ। | COL6A1, COL6A2, COL6A3 | अलरिच मायोपथी और बेथलेम मायोपथी | - | VII | त्वचीय बाह्य त्वचीय जंक्शन में स्थिरता देने वाले रेशे के रूप में | COL7A1 | बाह्यत्वचालयन जलस्फोटी अपविकास | - | VIII | कुछ अंतर्कला कोशिकाएं | COL8A1, COL8A2 | पिछला बहुरूपी कॉर्निया कुपोषण 2 | - | IX | FACIT कोलेजन, उपास्थि, टाइप II और XI तंतुओं के साथ जुड़े | COL9A1, COL9A2, COL9A3 | EDM2 - और EDM3 | - | X | अतिवृद्धि और खनिजीकृत उपास्थि | COL10A1 | श्मिड मेटाफ़िसीयल डिस्प्लासिया | - | XI | उपास्थि | COL11A1, COL11A2 | कोलेजनोपथी, टाइप II और XI | - | XII | FACIT कोलेजन, फ़ाइब्रिल, डेकोरिन और ग्लाइकोसअमिनोग्लाइकान्स युक्त टाइप I के साथ प्रतिक्रिया करता है | COL12A1 | - | - | XIII | ट्रैन्समेंब्रेन कोलेजन, a1b1 इंटीग्रिन, फ़ाइब्रोनेक्टिन और निडोजन तथा परलेकन जैसे आधार झिल्लियों के घटकों के साथ प्रतिक्रिया करता है। | COL13A1 | - | - | XIV | FACIT कोलेजन | COL14A1 | - | - | XV | - | COL15A1 | - | - | XVI | - | COL16A1 | - | - | XVII | ट्रैन्समेंब्रेन कोलेजन, जो बतौर BP180 भी जाना जाता है, जोकि 180 kDa प्रोटीन है | COL17A1 | जलस्फोटी पेम्फीगोइड और संयोजी बाह्यत्वचालयन जलस्फोट | - | XVIII | एंडोस्टैटिन के स्रोत | COL18A1 | - | - | XIX | FACIT कोलेजन | COL19A1 | - | - | XX | - | COL20A1 | - | - | XXI | FACIT कोलेजन | COL21A1 | - | - | XXII | - | COL22A1 | - | - | XXIII | MACIT कोलेजन - | COL23A1 | - | - | XXIV | - | COL24A1 | - | - | XXV | - | COL25A1 | - | - | XXVI | - | EMID2 | - | - | XXVII | - | COL27A1 | - | - | XXVIII | - | COL28A1 | - | - | XXIX | बाह्यत्वचीय कोलेजन | COL29A1 | एटॉपिक डर्माटिटिस[24] |
ऊपर उल्लिखित विकारों के अलावा, त्वचाकाठिन्य में अधिक कोलेजन जमा होता है।
अभिरंजन
ऊतक-विज्ञान में, कोलेजन मानक H&E स्लाइडों में चमकदार इयोसिनोफ़िलिक (गुलाबी) है। ऊतक नमूनों में कोलेजन को रंगने के लिए अधिरंजक मिथाइल वायोलेट का इस्तेमाल किया जा सकता है।
कोलेजन को रंगने के लिए अधिरंजक मिथाइल ब्लू का भी उपयोग किया जा सकता है और यदि आवश्यक हो, तो प्रतिरक्षाऊतकरसायन अधिरंजक उपलब्ध हैं।
अन्य तंतुओं से कोलेजन को अलग पहचानने के लिए उपयोगार्थ सर्वश्रेष्ठ अधिरंजक है मैसन का ट्राइक्रोम.
संश्लेषण
एमिनो एसिड
कोलेजन में एक असामान्य एमिनो एसिड संरचना और अनुक्रम है:
- ग्लाइसिन (Gly) लगभग हर तीसरे अवशेष में पाया जाता है
- प्रोलाइन (Pro) से कोलेजन का लगभग 9% बना है
- कोलेजन में दो असामान्य व्युत्पन्न एमिनो एसिड शामिल है, जो उद्ग्रहण के दौरान सीधे प्रविष्ट नहीं होते. ये एमिनो एसिड ग्लाइसिन के सापेक्ष विशिष्ट जगहों में पाए जाते हैं और विभिन्न एन्ज़ाइमों द्वारा उद्ग्रहणोत्तर परिवर्धित किए जाते हैं, जिन दोनों के लिए विटामिन C सहघटक के रूप में अपेक्षित है।
- हाइड्रॉक्सिप्रोलाइन (Hyp), प्रोलाइन से व्युत्पन्न.
- हाइड्रॉक्सिलाइसिन, लाइसिन से व्युत्पन्न. कोलेजन के प्रकार पर निर्भर करते हुए, अनगिनत हाइड्रॉक्सिलाइसिन से डिसैकराइड जुड़े होते हैं।
कॉर्टिसोल त्वचीय कोलेजन से एमिनो एसिड के निम्नीक्रमण को उत्तेजित करता है।[25]
कोलेजन I संघटन
अधिकांश कोलेजन एक जैसे तरीके से रचे जाते हैं, लेकिन टाइप I के लिए निम्नलिखित प्रक्रिया विशिष्ट है:
- कोशिका के अंदर
- खुरदुरे अंतःप्रद्रव्य जालिका (RER) के साथ राइबोसोम में तीन पेप्टाइड श्रृंखलाओं का गठन होता है (2 अल्फा-1 और 1 अल्फा-2-श्रृंखला). इन पेप्टाइड श्रृंखलाओं में (प्रीप्रोकोलेजन के रूप में ज्ञात) प्रत्येक सिरे पर रजिस्ट्रेशन पेप्टाइड होते हैं; और प्रत्येक के साथ एक एकल सिग्नल पेप्टाइड भी होता है
- पेप्टाइड श्रृंखलाओं को RER के लुमेन में भेजा जाता है
- सिग्नल पेप्टाइड्स RER के अंदर चिपके रहते हैं और अब श्रृंखलाएं प्रोकोलेजन के रूप में जानी जाती हैं
- लाइसिन और प्रोलाइन एमिनो एसिडों का हाइड्रॉक्सिलेशन लुमेन के अंदर होता है। यह प्रक्रिया सहघटक के रूप में एस्कॉर्बिक एसिड (विटामिन C) पर निर्भर है
- विशिष्ट हाइड्रॉक्सिलेटेड एमिनो एसिड का ग्लाइकोसिलेशन होता है
- RER के अंदर ट्रिपल पेचदार संरचना बनती है
- प्रोकोलेजन गॉल्जी उपकरण को भेजे जाते हैं, जहां वे पैक और एक्सोसाइटॉसिस द्वारा निस्सारित किए जाते हैं
- कोशिका के बाहर
- रजिस्ट्रेशन पेप्टाइड्स चिपके रहते हैं और प्रोकोलेजन पेप्टीडेस द्वारा ट्रोपोकोलेजन संघटित होता है।
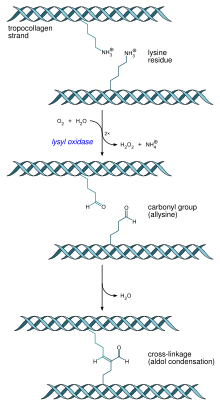
- एकाधिक ट्रोपोकोलेजन अणु, हाइड्रॉक्सिलाइसिन तथा लाइसिन अवशेषों को जोड़ने वाले लाइसिल ऑक्सिडेस द्वारा सहसंयोजक तिर्यक बंधन के ज़रिए, कोलेजन तंतुओं का गठन करते हैं। एकाधिक कोलेजन तंतुओं से कोलेजन रेशों का गठन होता है
- कोलाजेन, फ़ाइब्रोनेक्टिन और इंटीग्रिन सहित, कई प्रकार के प्रोटीन के ज़रिए, कोशिका झिल्लियों से जुड़े होते हैं।
सिंथेटिक रोगजनन
विटामिन C की कमी से स्कर्वी रोग होता है, जो एक गंभीर और दर्दनाक बीमारी है, जिसमें दोषपूर्ण कोलेजन मजबूत संयोजी ऊतक के गठन को रोकता है। मसूड़े ख़राब हो जाते हैं और दांत गिरने के साथ उनसे खून बहने लगता है; त्वचा फीकी पड़ जाती है और घाव नहीं भरते हैं। अठारहवीं सदी से पहले, यह दशा लंबी अवधि के सैन्य, विशेषकर नौसेना अभियानों में कुख्यात था, जिसके दौरान प्रतिभागियों को विटामिन C युक्त खाद्य पदार्थों से वंचित रखा जाता था।
रक्तिम त्वचायक्ष्मा या गठियारूप संधिशोथ जैसे स्वप्रतिरक्षी रोग का स्वस्थ कोलेजन तंतुओं पर हमला हो सकता है।
कई बैक्टीरिया और वायरस विषैलेपन के कारक हैं, जो कोलेजन नष्ट करते हैं या उसके उत्पादन में हस्तक्षेप करते हैं।
प्रयोग
कोलेजन लंबे, तंतुमय संरचनात्मक प्रोटीनों में से एक है, जिसका कार्य एंज़ाइम जैसे गोलाकार प्रोटीनों से काफी अलग है। कोलेजन फाइबर कहे जाने वाले कोलेजन के मज़बूत बंडल, बहिर्कोशिकीय मैट्रिक्स के प्रमुख घटक है जो अधिकांश ऊतकों को समर्थन देते हैं और बाहर से कोशिका की संरचना करते हैं, लेकिन कोलेजन कुछ कोशिकाओं में ये अंदर भी पाए जाते हैं। कोलेजन में अधिक तन्य शक्ति है और यह प्रावरणी, उपास्थि, स्नायु, कंडरा, हड्डी और त्वचा का मुख्य घटक है।[26][27] मुलायम केरातिन के साथ, यह त्वचा के लोच और शक्ति के लिए जिम्मेदार है और इसके अपकर्ष से उम्र के बढ़ने के साथ झुर्रियां पड़ने लगती हैं। यह धमनियों को मज़बूत करता है और ऊतकों के विकास में भूमिका निभाता है। यह क्रिस्टलीय स्वरूप में कॉर्निया और आंख के लेंस में मौजूद रहता है। इसका उपयोग कॉस्मेटिक सर्जरी और दाहक सर्जरी में किया जाता है। हाइड्रोलाइज़ कोलेजन प्रोटीन के रूप में वज़न प्रबंधन में महत्वपूर्ण भूमिका निभा सकता है, उसकी परितृप्ति शक्ति के लिए फ़ायदेमंद तरीक़े से इसका इस्तेमाल किया जा सकता है।[]
औद्योगिक उपयोग
अगर कोलेजन को पर्याप्त रूप से विकृत किया जाए, जैसे तापन द्वारा, तीन ट्रोपोकोलेजन रेशे गोलाकार डोमेन में आंशिक रूप से या पूर्णतः अलग हो जाते हैं, जिसमें एक अलग सामान्य कोलेजन पॉलीप्रोलाइन II (PPII) गौण संरचना शामिल होती है, उदा. यादृच्छिक कॉयल यह प्रक्रिया जेलटिन के गठन को वर्णित करती है, जिसका उपयोग फ़्लेवर्ड जेलटिन डेज़र्ट सहित कई खाद्य-सामग्रियों में किया जाता है। खाद्य-पदार्थों के अलावा, जेलटिन का उपयोग औषधीय, कॉस्मेटिक और फ़ोटोग्राफ़ी उद्योगों में किया जाता है।[28] पोषण की दृष्टि से, कोलेजन और जेलटिन प्रोटीन के ख़राब गुणवत्ता वाले एकल स्रोत हैं, चूंकि उनमें मानव शरीर की ज़रूरत के अनुसार सभी आवश्यक एमिनो एसिड शामिल नहीं हैं—वे 'संपूर्ण प्रोटीन' नहीं हैं (जैसा कि खाद्य-विज्ञान में परिभाषित किया गया है, इसलिए नहीं कि वे आंशिक रूप से संरचित हैं). कोलेजन-आधारित पथ्य पूरक आहार निर्माताओं का दावा है कि उनके उत्पाद त्वचा और नाखून की गुणवत्ता तथा साथ ही जोड़ों के स्वास्थ्य में सुधार कर सकते हैं। तथापि, इन दावों के समर्थन में मुख्यधारा के वैज्ञानिक अनुसंधान ने कोई मज़बूत सबूत नहीं दिखाए हैं।[] इन क्षेत्रों में समस्याओं से जूझने वाले व्यक्ति सामान्यतः केवल प्रोटीन की कमी नहीं बल्कि किसी अन्य अंतर्निहित दशा से पीड़ित हो सकते हैं (जैसे सामान्य तौर पर उम्र बढ़ना, शुष्क त्वचा, गठिया आदि).
यूनानी में गोंद के लिए प्रयुक्त शब्द कोला से व्युत्पन्न कोलेजन का अर्थ है "गोंद निर्माता" और गोंद प्राप्त करने के लिए घोड़े तथा अन्य जानवरों की त्वचा और नसों को उबालने की प्राचीन प्रक्रिया को सन्दर्भित करता है। 4,000 साल पहले मिस्रवासियों द्वारा कोलेजन आसंजक का उपयोग किया जाता था और 1,500 साल पहले मूल अमेरिकी धनुष में इसका प्रयोग करते थे। दुनिया में सबसे पुराना गोंद, कार्बन-कालनिर्धारण के अनुसार 8000 वर्ष से अधिक पुराना जो पाया गया, वह है कोलेजन—जिसका उपयोग रस्सी की टोकरियों और कढ़ाई किए गए कपड़ों में सुरक्षात्मक अस्तर के रूप में और बर्तनों को साथ जोड़ने; और साथ ही मानव खोपड़ी पर सजावट के लिए किया जाता था।[29] सामान्य रूप से कोलेजन जेलटिन में बदलता है, लेकिन सूखी स्थिति के कारण बच गया। पशु गोंद थर्मोप्लास्टिक हैं, जो दुबारा गर्म करने पर नरम पड़ जाते हैं और इसलिए वे अभी भी संगीत वाद्य-यंत्रों के निर्माण में प्रयुक्त किए जा रहे हैं, जैसे बढ़िया वायलिन और गिटार, जिनकी मरम्मत के लिए उन्हें खोलने की ज़रूरत होती है—एक अनुप्रयोग जो कठोर, सिंथेटिक प्लास्टिक गोंद के साथ मुश्किल है, जोकि स्थाई होते हैं। चमड़े सहित पशुओं की नसें और खाल, सदियों से उपयोगी सामग्री बनाने में इस्तेमाल होता रहा है।
जेलटिन-रीसोरसिनॉल फ़ॉरमाल्डिहाइड गोंद (और कम विषैले पेन्टेनेडियल तथा एथेनेडियल द्वारा प्रतिस्थापित फ़ॉर्माल्डिहाइड) का उपयोग खरगोश के फेफड़ों में प्रयोगात्मक चीर-काट की मरम्मत के लिए किया गया है।[30]
चिकित्सीय उपयोग
हृदय वाल्व वलय, केंद्रीय शरीर और के हृदय का कार्डियक कंकाल, हृदय के द्रव यांत्रिकी के लिए सरसरी तौर पर एक अद्वितीय और गतिमान कोलेजन का प्रतिनिधित्व करते हैं। व्यक्तिगत हृदकपाटीय पर्णक विवादास्पद तौर पर अत्यधिक दबाव में कोलेजन द्वारा आकार में धारित रहते हैं। उम्र बढ़ने के स्वाभाविक परिणामस्वरूप कोलेजन के भीतर कैल्शियम जमा होता है। ख़ून और मांसपेशियों के अन्यथा स्थिर प्रदर्शन में ये निश्चित बिंदु, अनुपात जानने के लिए वर्तमान कार्डियाक इमेजिंग तकनीक को सक्षम करते हैं जहां अनिवार्यतः कार्डियाक इनपुट में ख़ून का प्रवेश और कार्डियाक आउटपुट में ख़ून का निर्गम निर्दिष्ट होता है। निर्दिष्ट इमेजिंग जैसे कैल्शियम स्कोरिंग जैसे इस पद्धति क दर्शाता है, विशेषकर कोलेजन मज़बूती के लिए विकृति विज्ञान के प्रयोगार्थ वृद्ध रोगी के मामले में.
कोलेजन का कॉस्मेटिक सर्जरी में जले हुए रोगियों के लिए चिकित्सीय सहायता, हड्डियों के पुनर्निर्माण और दंत चिकित्सा, विकलांग और शल्य चिकित्सा जैसे विविध प्रयोजनों के लिए व्यापक रूप से इस्तेमाल किया जाता है। कुछ दिलचस्प विषय हैं:
- जब कॉस्मेटिक तौर पर उपयोग किया है, तब लंबे समय तक लालिमा जैसी एलर्जी प्रतिक्रियाएं हो सकती हैं; तथापि, कॉस्मेटिक उपयोग से पहले आसान और अगोचर पैच परीक्षण द्वारा लगभग इसकी संभावना को समाप्त किया जा सकता है
- अधिकांश चिकित्सीय कोलेजन, मुक्त जानवर जो BSE (बोवाइन स्पांजीफ़ार्म एनसेफ़लोपथी) द्वारा प्रमाणित ताज़ा गोमांस (बोवाइन) से व्युत्पन्न होता है। अधिकांश निर्माता या तो "बंद झुंड" से, या दाता देशों से जानवरों का उपयोग करते हैं, या फिर ऐसे देशों से जहां कभी BSE का कोई मामला रिपोर्ट नहीं किया गया हो, जैसे आस्ट्रेलिया, ब्राजील और न्यूजीलैंड.
- विभिन्न शल्य-चिकित्सा के प्रयोजनों के लिए कोलेजन शीट के उत्पादन हेतु पोर्सिनो (सुअर) ऊतक का भी व्यापक रूप से इस्तेमाल किया जाता है।
- स्वयं रोगी का वसा, हाइअल्युरोनिक एसिड या पॉलीएक्रिलमाइड जेल के उपयोग से विकल्प आसानी से उपलब्ध हैं।
गंभीर दहन के प्रबंधन में कृत्रिम त्वचा प्रतिस्थापकों के निर्माण के लिए कोलेजन का व्यापक रूप से उपयोग किया जाता है। ये कोलेजन बोवाइन, इक्वाइन या पोर्सिन और मानव स्रोतों से भू व्युत्पन्न किए जा सकते हैं और कभी-कभी सिलिकॉन, ग्लाइकोसअमिनोग्लाइकन्स, फ़ाइब्रोब्लास्ट, वृद्धि कारक या अन्य पदार्थों के संयोजन से भी इस्तेमाल किए जाते हैं।
कोलेजन जोड़ों की गतिशीलता के पूरक के रूप में भी व्यावसायिक तौर पर बेचा जाता है।[31] क्योंकि अवशोषण से पहले प्रोटीन को एमीनो एसिड में खंडित किया जाता है, कोई कारण नहीं कि मौखिक रूप से अंतर्ग्रहित कोलेजन शरीर के संयोजी ऊतक को प्रभावित करे, सिवाय व्यक्तिगत एमीनो एसिड अनुपूरण के प्रभाव के माध्यम से.
हाल ही में पशुओं से व्युत्पन्न कोलेजन के लिए एक विकल्प उपलब्ध हो गया है। हालांकि महंगा है, दाता शवों, गर्भनालों और गर्भपात भ्रूणों से व्युत्पन्न यह मानव कोलेजन, प्रतिरक्षा प्रतिक्रियाओं की संभावना को कम कर सकते हैं।
हालांकि यह त्वचा के माध्यम से अवशोषित नहीं किया जा सकता है, अब कुछ श्रृंगार प्रसाधन सामग्री में एक मुख्य घटक के रूप में कोलेजन का इस्तेमाल किया जा रहा है।[32]
जीवाश्म रिकॉर्ड
चूंकि कोलेजन के संश्लेषण के लिए उच्च स्तरीय वायुमंडलीय ऑक्सीजन की आवश्यकता होती है, जटिल जानवर तब तक विकसित होने में सक्षम ना रहे होंगे, जब तक कि कोलेजन संश्लेषण के लिए वायुमंडल में पर्याप्त ऑक्सीजन रहा हो। [33] कोलेजन की उत्पत्ति ने उपचर्म, खोल और मांसपेशियों के निर्माण को अनुमत किया होगा। तथापि, जीवाश्म रिकॉर्ड में कोलेजन संरक्षण बहुत दुर्लभ है।[34] ऐसे कई प्रमाण हैं—जो विवादास्पद बने हुए हैं—कि कोलेजन नमूने डायनासोर में लंबे समय पूर्व से ही संरक्षित किए गए हैंसाँचा:Ma/1 million years ago.[35]
इसके अलावा नोटिंग के लायक हैं, टीरोसॉर्स के पंखों पर किरण-तंतुक, कोलेजन रेशे.
कला

जूलियन वॉस-एंड्रिया ने कोलेजन संरचना के आधार पर बांस और स्टेनलेस स्टील से प्रतिमाएं बनाई हैं। उनकी रचना अनरैवलिंग कोलेजन, उनके अनुसार, "कालप्रभावन और वृद्धि का रूपक" है।[36][37]
इन्हें भी देखें
- पशु गोंद
- कोलेजिनेस, कोलेजन भंग और पुनःप्रतिरूपण में शामिल एन्ज़ाइम. कोलेजन पर लक्ष्य साधने वाले अन्य प्रोटीस पर अधिक जानकारी के लिए देखें प्रोटियोलिसिस मैप
- एहलर्स-डैनलोस सिंड्रोम
- तंतुमय प्रोटीन
- जिलेटिन
- अतिगतिकता सिंड्रोम
- LOXL1
- LOXL2
- LOXL3
- LOXL4
- मारफन सिंड्रोम
- अस्थिरूप
सन्दर्भ
- ↑ मुलर, वर्नर ई.जी. द ऑरिजिन ऑफ़ मेटाज़ोअन कॉम्प्लेक्सिटी: पोरिफ़ेरा ऐस इंटिग्रेटेड एनिमल्स. एकीकृत परिकलनीय जीवविज्ञान, 43:3-10, 2003.
- ↑ ग्लोरिया ए. डी लुलोडैगर, शॉन एम. स्वीनी, जार्मो कोर्को, लीना अला-कोको और जेम्स डी. सैन एंटोनियो; Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen Archived 2009-06-15 at the वेबैक मशीन; जे. बयॉल. केम. खंड. 277, अंक 6, 4223-4231, 8 फ़रवरी 2002
- ↑ सिकोर्स्की, ज़्डज़िसलॉ ई. (2001) केमिकल एंड फंक्शनल प्रॉपर्टीज़ ऑफ़ फ़ुड प्रोटीन्स . सीआरसी प्रेस. पृ. 242
- ↑ वाइकॉफ़, आर., आर. कोरी और जे. बिसको, पुट्ठों से लंबी दूरी पर X-किरण प्रतिबिंब. विज्ञान, 1935. 82: पृ. 175-176.
- ↑ क्लार्क, जी., पार्कर, ई., स्काद, जे. और वॉरेन, W.J, प्राकृतिक सामग्री में पहले अज्ञात अंतरतलीय अंतरालों की नई माप. जे. आमेर. केम. सोश, 1935. 57: पृ. 1509-1509.
- ↑ GNR — A Tribute - Resonance - October 2001
- ↑ "संग्रहीत प्रति" (PDF). मूल (PDF) से 16 दिसंबर 2008 को पुरालेखित. अभिगमन तिथि 30 अप्रैल 2010.
- ↑ G.N. Ramachandran - Nature Structural & Molecular Biology
- ↑ फ़्रेज़र, आर.डी., टी.पी. मॅकरै और ई. सुज़ुकी, कोलैजेन अणु में श्रृंखला संरचना. जे. मॉल बॉय, 1979. 129 (3): पृ. 463-81
- ↑ ओकुयामा, के. आदि., कोलेजन जैसे पॉलीपेप्टाइड की क्रिस्टल और आण्विक संरचना (Pro-Pro-Gly)10. जे मॉल बॉय, 1981. 152 (2): पृ. 427-43.
- ↑ ट्राब, डब्ल्यू., ए. योनाथ और डी.एम. सेगल, कोलेजन की आण्विक संरचना पर. प्रकृति, 1969. 221 (5184): पृ. 914-7.
- ↑ बेल्ला, जे., एम. ईटन, बी. ब्रॉड्स्की और एच.एम. बरमन, 1.9 A रेज़ल्यूशन पर कोलेजन-जैसे पेप्टाइड की क्रिस्टल और आण्विक संरचना. विज्ञान, 1994. 266 (5182): पृ. 75-81.
- ↑ अ आ ह्युम्स, डी.जे. और ए. मिलर, कोलेजन तंतुओं में अर्ध-षड्भुजाकार आण्विक पैकिंग. प्रकृति, 1979. 282 (5741): पृ. 878-80.
- ↑ जेसियर, जे.सी., ए. मिलर और सी. बरथेट-कोलोमिनास, टाइप I कोलेजन तंतुओं की सामान्य विशेषता क्रिस्टलीय तीन आयामी पैकिंग है। FEBS लेट, 1980. 113 (2): पृ. 238-40.
- ↑ फ्रेजर, RDB और टी.पी. मॅकरै, पुट्ठों के कोलेजन में यूनिट सेल और आण्विक संयोजन. इंट. जे.बॉय. मैक्रोमोल. 1981,. 3: पृ. 193-200.
- ↑ फ्रेजर, आर.डी., टी.पी. मॅकरै और ए. मिलर, टाइप I कोलेजन तंतुओं में आण्विक पैकिंग. जे मॉल बॉय, 1987. 193 (1): पृ. 115-25.
- ↑ वेस, टी.जे., आदि., पुट्ठों में टाइप I कोलेजन की आण्विक पैकिंग. जे मॉल बॉय, 1998. 275 (2): पृ. 255-67.
- ↑ अ आ इ ओरजेल, जे.पी., आदि. "स्वस्थानी टाइप I कोलेजन की सूक्ष्मतंतुमय संरचना". अमेरिकी राष्ट्रीय विज्ञान अकादमी की कार्यवाही 2006. 103 (24): पृ. 9001-5.
- ↑ ह्युम्स, डी.जे., कोलेजन अणुओं, तंतुओं और अधितंतुमय संरचनाओं का गठन. जे स्ट्रक बॉय, 2002. 137 (1-2): पृ. 2.10
- ↑ अ आ ह्युम्स, डी.जे., कोलेजेन सुपरपरिवार-विविध संरचनाएं और संयोजन. निबंध बायोकेम, 1992. 27: पृ. 49-67.
- ↑ पेरूमल, एस., ओ. एंटीपोवा और जे.पी.ओरजेल, कोलेजेन तंतु संरचना, डोमेन संगठन और तिहरी-कुंडलीदार संरचना उसकी प्रोटियोलिसिस को नियंत्रित करती है। अमेरिकी राष्ट्रीय विज्ञान अकादमी की कार्यवाही, 2008. 105 (8): पृ. 2824-9.
- ↑ स्वीनी, एस. एम., आदि., उम्मीदवार कोशिका और कोलेजेन तंतु पर मैट्रिक्स अन्योन्य क्रिया डोमेन और कशेरुकियों की प्रमुख प्रोटीन. जर्नल ऑफ़ बायोलाजिकल केमिस्ट्री, 2008. 283 (30): पृ. 21187-97.
- ↑ ट्वार्डोव्स्की, टी., आदि., एंजियोजेनेसिस माइमेटिक्स सुपरपॉलिमर के रूप में टाइप I कोलेजन और कोलेजन माइमेटिक्स. कर फार्म डेस 2007. 13 (35): पृ. 3608-21.
- ↑ सोडरहॉल सी, मारेनहोल्ज़ आई, केर्सचर टी, रुसचेन्डॉर्फ़ एफ़, एस्पार्ज़ा-गोर्डिलो जे, आदि., Variants in a Novel Epidermal Collagen Gene (COL29A1) Are Associated with Atopic Dermatitis.[मृत कड़ियाँ] . PLoS जीव विज्ञान खंड. 5, नं. 9 e242 doi:10.1371/journal.pbio.0050242
- ↑ हाउक, जे.सी.; शर्मा, वि.के.; पटेल, वाइ.एम.; ग्लैडनर, जे.ए.(1968) "त्वचा और तंतुप्रसू में प्रदाहकरोधी औषधि द्वारा कोलेजनोलिटिक और प्रोटियोलिटिक क्रियाओं का प्रेरण". बायोकेमिकल फार्माकोलॉजी़ 17: 2081,
- ↑ फ़्राट्ज़ल पी. कोलेजन: संरचना और यांत्रिकी. स्प्रिंजर, न्यूयॉर्क, 2008
- ↑ ब्युह्लर, एम.जे., "प्रकृति द्वारा मज़बूत कोलेजन डिजाइन: कोलेजन तंतुओं की अतिसूक्ष्म संरचना की व्याख्या". अमेरिकी राष्ट्रीय विज्ञान अकादमी की कार्यवाही 2006. 103 (33): पृ. 12285-90.
- ↑ "Gelatin's Advantages: Health, Nutrition and Safety". मूल से 9 जून 2012 को पुरालेखित. अभिगमन तिथि 30 अप्रैल 2010.
- ↑ "Oldest Glue Discovered". मूल से 17 दिसंबर 2005 को पुरालेखित. अभिगमन तिथि 30 अप्रैल 2010.
- ↑ एन थोरैक सर्ज. 1994, जून 57 (6): 1622-7
- ↑ Hydrolyzed Collagen pills usages
- ↑ "संग्रहीत प्रति". मूल से 22 जुलाई 2009 को पुरालेखित. अभिगमन तिथि 30 अप्रैल 2010.
- ↑ "संग्रहीत प्रति". मूल से 29 अक्तूबर 2012 को पुरालेखित. अभिगमन तिथि 30 अप्रैल 2010.
- ↑ doi:10.1111/j.1502-3931.1996.tb01844.x
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ doi:10.1126/science.1165069
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ Ward, Barbara (2006). "'Unraveling Collagen' structure to be installed in Orange Memorial Park Sculpture Garden". Expert Rev. Proteomics. 3 (2): 174. डीओआइ:10.1586/14789450.3.2.169. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ "Interview with J. Voss-Andreae "Seeing Below the Surface" in Seed Magazine". मूल से 29 जून 2012 को पुरालेखित. अभिगमन तिथि 30 अप्रैल 2010.
बाहरी कड़ियाँ
- The Collagen Protein
- 12 types of collagen
- Database of type I and type III collagen mutations
- Science.dirbix Collagen Archived 2011-04-02 at the वेबैक मशीन
- Collagen Stability Calculator
- Computer-generated animations of the assembly of Type I and Type IV Collagens Archived 2011-01-04 at the वेबैक मशीन
- Integrin-Collagen interface, PMAP (प्रोटियोलिसिस मानचित्र)-एनिमेशन
- Integrin-Collagen binding model, PMAP (प्रोटियोलिसिस मानचित्र)-एनिमेशन
- Collagen-Integrin atomic detail, PMAP (प्रोटियोलिसिस मानचित्र)-एनिमेशन
- Medical collagen 3D Archived 2010-06-26 at the वेबैक मशीन