ऊर्जाक्षेपी अभिक्रिया
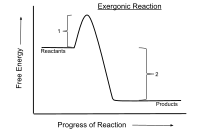
रासायनिक ऊष्मागतिकी में, एक एक्सर्जोनिक प्रतिक्रिया (अंग्रेज़ी: Exergonic reaction) एक रासायनिक अभिक्रिया है जिसमें मुक्त ऊर्जा में परिवर्तन ऋणात्मक होता है क्योंकि इसमें मुक्त ऊर्जा उत्सर्जित होती है।[1] बंद तंत्र में यह स्वतः अभिक्रिया को निरूपित करती है जिसमें अभिक्रिया के पूर्व और पश्चात् तापमान समान रहता है। स्थिर दबाव और तापमान पर एक बंद तंत्र में होने वाली प्रक्रियाओं के लिए गिब्स मुक्त ऊर्जा का उपयोग किया जाता है जबकि हेल्महोल्ट्ज़ ऊर्जा उन प्रक्रियाओं के लिए प्रासंगिक है जो स्थिर मात्रा और तापमान पर होती हैं। ऊष्मागतिकी का दूसरा नियम के अनुसार, विद्युत या फोटॉन ऊर्जा के इनपुट के बिना स्थिर तापमान पर होने वाली कोई भी प्रतिक्रिया एक्सर्जोनिक होती है। एक उदाहरण है कोशिकीय श्वसन।
प्रतीकात्मक रूप से, एक बाह्य प्रतिक्रिया में (निरंतर दबाव और तापमान पर) मुक्त ऊर्जा, G की रिहाई को इस प्रकार दर्शाया जाता है
हालाँकि ऐसा कहा जाता है कि बाहरी प्रतिक्रियाएँ स्वतःस्फूर्त होती हैं, लेकिन इसका मतलब यह नहीं है कि प्रतिक्रिया एक अवलोकन योग्य दर पर होगी। उदाहरण के लिए, हाइड्रोजन पेरोक्साइड का अनुपातहीन होना मुक्त ऊर्जा जारी करता है लेकिन उपयुक्त उत्प्रेरक की अनुपस्थिति में यह बहुत धीमी है। यह सुझाव दिया गया है कि इस संदर्भ में उत्सुक अधिक सहज शब्द होगा।[2]
अधिक सामान्यतः, शब्द ऊर्जाक्षेपी और ऊर्जाशोषी, केवल रासायनिक प्रतिक्रियाओं से ही नहीं, बल्कि किसी भी प्रक्रिया में होने वाले मुक्त ऊर्जा परिवर्तन से संबंधित हैं। इसके विपरीत, शब्द ऊष्माक्षेपी और ऊष्माशोषी एक प्रक्रिया के दौरान एक बंद सिस्टम में एन्थैल्पी परिवर्तन से संबंधित होते हैं, जो आमतौर पर ऊष्मा के आदान-प्रदान से जुड़े होते हैं।
इन्हें भी देखें
सन्दर्भ
- ↑ आईयूपीएसी गोल्ड बुक की परिभाषा: exergonic reaction (exoergic reaction)
- ↑ Hamori, Eugene; James E. Muldrey (1984). "Use of the word "eager" instead of "spontaneous" for the description of exergonic reactions". Journal of Chemical Education. 61 (8): 710. डीओआइ:10.1021/ed061p710. बिबकोड:1984JChEd..61..710H.
