विद्युत द्विध्रुव आघूर्ण
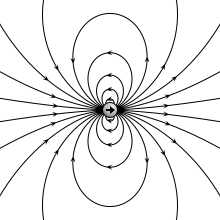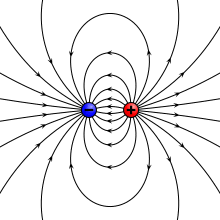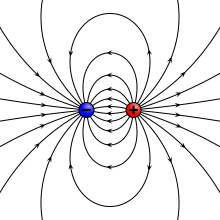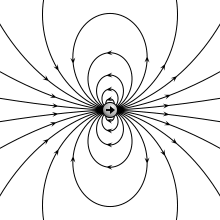
वैद्युत द्विध्रुव (इलेक्ट्रिक डाइपोल) वह निकाय (सिस्टम) है जिसमे दो बराबर परन्तु विपरीत प्रकार के बिन्दु आवेश एक-दूसरे से अल्प दूरी पर स्थित होते हैं। किसी एक आवेश तथा दोनो आवेशों के बीच की दूरी के गुणनफल को वैद्युत द्विध्रुव आघूर्ण (electric dipole moment) p कहते हैं। वास्तव में वैद्युत द्विध्रुव आघूर्ण उस निकाय में हुए आवेशों के ध्रुवीकरण को मापता है और अन्तर्राष्ट्रीय इकाई प्रणाली में इसकी इकाई कूलम्ब-मीटर है।[1][2]
प्रकृति मे विभिन्न स्थितियों मे वैद्युत द्विध्रुव प्रकट होता है। दोनो आवेशो को मिलाने वाली रेखा को द्विध्रुव की अक्ष कहते हैं। यदि वैद्युत द्विध्रुव के दोनो आवेश -q तथा +q कूलॉम हों तथा उनके बीच की दूरी 2l मीटर हो तब वैद्युत द्विध्रुव का आघूर्ण ( p = q.2l) होता है। वैद्युत द्विध्रुव आघूर्ण एक सदिश है जिसकी दिशा प्रायः ऋणात्मक आवेश से धनात्मक आवेश की तरफ लिया जाता है।
सरल परिभाषा
यदि दो बराबर के बिन्दु आवेश (चार्ज) हों - एक ऋणात्मक और दूसरा धनात्मक - जिन्हें +q और −q लिखा जाये और उन दोनों के बीच का (ऋणात्मक से धनात्मक दिशा में जाता हुआ) विस्थापन सदिश (डिसप्लेसमेंट वेक्टर) d हो, तो अगर विद्युत द्विध्रुव आघूर्ण को p द्वारा दिखाया जाये तो वह इस प्रकार होगा:
इसमें p की दिशा भी ऋणात्मक से धनात्मक की ओर होगी।
यदि बहुत से बिन्दु आवेश हों तो उनका विद्युत द्विध्रुवाघूर्ण निम्नलिखित तरीके से परिभाषित किया जाता है-
- ,
जहाँ , आवेश का स्थिति सदिश है।
- विद्युत क्षेत्र E में रखे द्विध्रुव पर लगने वाला बलाघूर्ण
- .
कुछ अणुओं के विद्युत द्विध्रुव आघूर्ण

−δ: ऋणात्मक आवेश
+δ: धनात्मक आवेश
p: द्विध्रुव आघूर्ण
| अणु | द्विध्रुवाघूर्ण Debye में | द्विध्रुवाघूर्ण 10−30 C·m में |
|---|---|---|
| CO[4] | 0,11 | 0,367 |
| HF[4] | 1,826178 | 6,0915 |
| HCl[4] | 1,109 | 3,700 |
| HBr[4] | 0,827 | 2,759 |
| HI[4] | 0,448 | 1,495 |
| NH3[4] | 1,471 | 4,907 |
| PF3[5] | 1,025 | 3,419 |
| H2O[6] | 1,84 | 6,152 |
| H2S[4] | 0,97 | 3,236 |
| CH2O[7] | 2,34 | 7,806 |
| NaCl[8] | 8,5 | 28,356 |
| KF[6] | 7,33 | 28,690 |
| KCl[6] | 10,48 | 34,261 |
| KBr[6] | 10,41 | 34,728 |
| KI[6] | 11,05 | 30,825 |
| CsCl[4] | 10,387 | 34,647 |
सन्दर्भ
- ↑ Raymond A. Serway, John W. Jewett, Jr. (2009). Physics for Scientists and Engineers, Volume 2 (8th ed.). Cengage Learning. p. 756. ISBN 1439048398.
- ↑ Christopher J. Cramer (2004). Essentials of computational chemistry (2 ed.). Wiley. p. 307. ISBN 0-470-09182-7.
- ↑ Bei einer Temperatur von 20 °C und einem Druck von 101,325 kPa.
- ↑ अ आ इ ई उ ऊ ए ऐ David R. Lide: CRC Handbook of Chemistry and Physics. 87. Auflage. B&T, ISBN 0-8493-0487-3.
- ↑ David Frank Eggers: Physical chemistry. Wiley, ISBN 978-0-471-23395-4, p. 572 (साँचा:Google Buch).
- ↑ अ आ इ ई उ BI Bleaney, Betty Isabelle Bleaney, Brebis Bleaney: Electricity and Magnetism, Volume 2 Third Edition. OUP Oxford, ISBN 978-0-19-964543-5, p. 303 (साँचा:Google Buch).
- ↑ Jean-Marie André, Joseph Delhalle, Jean Luc Brédas: Quantum Chemistry Aided Design of Organic Polymers An Introduction to the Quantum Chemistry of Polymers and Its Applications. World Scientific, ISBN 978-981-02-0004-6, p. 89 (साँचा:Google Buch).
- ↑ Jacob N. Israelachvili: Intermolecular and Surface Forces Revised Third Edition. Academic Press, ISBN 978-0-12-391927-4, p. 72 (साँचा:Google Buch).




