मानक संभवन पूर्णोष्मा
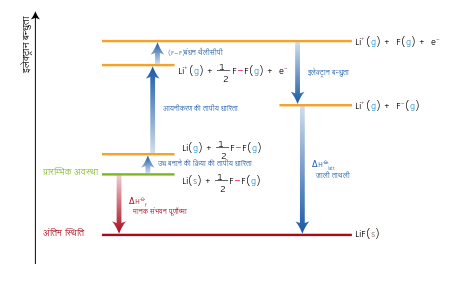
किसी यौगिक के संभवन (formation) के समय उसके १ मोल के निर्माण में होने वाला पूर्ण ऊष्मा परिवर्तन (change of enthalpy) उस यौगिक का मानक संभवन पूर्णोष्मा (standard enthalpy of formation) या मानक संभवन ऊष्मा (standard heat of formation) कहलाता है। यौगिक का निर्माण उसमें मौजूद तत्त्वों से होना चाहिये, तथा सभी पदार्थ अपने मानक अवस्था में तथा १ वायुमण्डलीय दाब पर होने चाहिये। मानक संभवन पूर्णोष्मा को ΔHfO या ΔfHO से दर्शाया जाता है। इस निरूपण में आने वाला थीटा (या शून्य) यह दिखाता है कि प्रक्रिया मानक स्थितियों में दिये हुए ताप पर (प्रायः 25 डिग्री सेल्सियस या 298.15 K) हुई है। मानक अवस्थाएं निम्नलिखित हैं-
- गैस के लिये : 1 वायुमण्डलीय दाब
- किसी आदर्श विलयन में घुले हुए विलेय के लिये : सान्द्रण 1 mole/liter, दाब १ वायुमण्डलीय
- For a pure substance or a solvent in a condensed state (a liquid or a solid): the standard state is the pure liquid or solid under a pressure of 1 atm
- For an element: the form in which the element is most stable under 1 atm of pressure. One exception is phosphorus, for which the most stable form at 1 atm is black phosphorus, but white phosphorus is chosen as the standard reference state for zero enthalpy of formation.[1]
उदाहरण के लिये, कार्बन डाई आक्साइड की मानक संभवन पूर्णोष्मा, निम्नलिखित अभिक्रिया की पूर्णोष्मा के बराबर होगी। (उपरोक्त स्थितियों के अन्तर्गत)
- C(s,graphite) + O2(g) → CO2(g)
सभी तत्व अपने मानक अवस्था में लिखे जाते हैं, तथा 1 मोल उत्पाद का निर्माण होता है। यह सभी संभवन पूर्णोष्माओं के लिये सत्य है।
उदाहरण: मानक संभवन पूर्णोष्मा ( 25°C, 298 K पर)
| रासायनिक यौगिक | प्रावस्था | रासायनिक सूत्र | Δ Hf0 in kJ/mol |
|---|---|---|---|
| एसीटोन | l | C3H6O | −248.4 |
| एसीटलीन | g | C2H2 | +227.4 |
| अमोनिया (Ammonium Hydroxide) | aq | NH3 (NH4OH) | −80.8 |
| Ammonia | g | NH3 | −46.1 |
| Ammonium nitrate | s | NH4NO3 | −365.6 |
| Benzene | l | C6H6 | +49.1 |
| Bromine | l | Br2 | 0 |
| Bromine | g | Br2 | +31 |
| Bromine | g | Br | +111.9 |
| Hydrogen bromide | g | HBr | −36.3 |
| Calcium | s | Ca | 0 |
| Calcium oxide | s | CaO | −634.9 |
| Calcium carbonate | s | CaCO3 | −1207.6 |
| Carbon | s | C (graphite) | 0 |
| Carbon | s | C (diamond) | +1.88 |
| Carbon monoxide | g | CO | −110.5 |
| Carbon dioxide | g | CO2 | −393.5 |
| Chlorine | g | Cl2 | 0 |
| Chlorine | g | Cl | +121.3 |
| Hydrogen chloride | g | HCl | −92.3 |
| Copper(II) sulfate | aq | CuSO4 | −769.98 |
| Ethane | g | C2H6 | −84.68 |
| Ethanol | l | C2H5OH | −277.6 |
| Ethylene | g | C2H4 | +52.4 |
| Fluorine | g | F2 | 0 |
| Fluorine | g | F | +79.38 |
| Hydrogen fluoride | g | HF | −273.3 |
| Glucose | s | C6H12O6 | −1273.3 |
| Hydrogen | g | H | +216 |
| Hydrogen | g | H2 | 0 |
| Iodine | s | I2 | 0 |
| Iodine | g | I2 | +62 |
| Isopropanol | g | C3H7OH | −318.1 |
| Methane | g | CH4 | −74.87 |
| Methanol | l | CH3OH | −238.6 |
| Nitrogen | g | N2 | 0 |
| Nitrogen dioxide | g | NO2 | +33.2 |
| Nitric oxide | g | NO | +91.3 |
| Oxygen | g | O | +249 |
| Oxygen | g | O2 | 0 |
| Ozone | g | O3 | +142.7 |
| Propane | g | C3H8 | −103.85 |
| Sodium | s | Na | 0 |
| Sodium | g | Na | +107.5 |
| Sodium bicarbonate | s | NaHCO3 | −950.8 |
| Sodium carbonate | s | Na2CO3 | −1131 |
| Sodium chloride (table salt) | aq | NaCl | −407 |
| Sodium chloride (table salt) | s | NaCl | −411.12 |
| Sodium chloride (table salt) | l | NaCl | −385.92 |
| Sodium chloride (table salt) | g | NaCl | −181.42 |
| Sodium hydroxide | aq | NaOH | −470.1 |
| Sodium hydroxide | s | NaOH | −426.7 |
| Sodium nitrate | aq | NaNO3 | −446.2 |
| Sodium nitrate | s | NaNO3 | −424.8 |
| Sucrose | s | C12H22O11 | −2226.1 |
| Sulfur (monoclinic) | s | S8 | 0.3 |
| Sulfur (rhombic) | s | S8 | 0 |
| Sulfur dioxide | g | SO2 | −296.8 |
| Sulfur trioxide | g | SO3 | −395.7 |
| Sulfuric acid | l | H2SO4 | −814 |
| Silica | s | SiO2 | −911 |
| Silver | s | Ag | 0 |
| Silver chloride | s | AgCl | −127.0 |
| Water | l | H2O | −285.8 |
| Water vapor | g | H2O | −241.82 |
| Zinc sulfate | s | ZnSO4 | −980.14 |
- (State: g = gaseous; l = liquid; s = solid; aq = aqueous)
सन्दर्भ
- ↑ "Principles of Modern Chemistry 547p". मूल से 10 नवंबर 2013 को पुरालेखित. अभिगमन तिथि 8 मार्च 2016.