क्रिया विभव
शरीरक्रियाविज्ञान में क्रिया विभव (ऐक्शन पोटेंशिअल) एक अल्प-जीवी घटना होती है जिसमें कोशिका की विद्युतीय झिल्ली क्षमता, रूढ़ प्रारूप पथ का अनुगमन करते हुए तेजी से चढ़ती और गिरती है। क्रिया विभव, कई प्रकार की जन्तु कोशिकाओं में होती है, जिसे उत्तेजनीय कोशिका कहा जाता है, जिसमें शामिल हैं न्यूरॉन, मांसपेशी कोशिका और अंतःस्रावी कोशिका। न्यूरॉन्स में, कोशिका से कोशिका संचार में वे एक केंद्रीय भूमिका निभाते हैं। अन्य प्रकार की कोशिकाओं में, उनका मुख्य कार्य अंतर-कोशिकीय प्रक्रियाओं को सक्रिय करना है। मांसपेशी कोशिकाओं में, उदाहरण के लिए, एक ऐक्शन पोटेंशिअल, संकुचन में फलित होने वाली घटनाओं की श्रृंखला में पहला कदम है। [] अग्न्याशय की बीटा कोशिका में, वे इंसुलिन के स्राव को प्रेरित करते हैं।[1] न्यूरॉन्स में ऐक्शन पोटेंशिअल को "तंत्रिका आवेग" या "स्पाइक्स" के रूप में भी जाना जाता है और न्यूरॉन द्वारा उत्पन्न ऐक्शन पोटेंशिअल का अस्थायी अनुक्रम उसका "स्पाइक ट्रेन" कहलाता है। एक न्यूरॉन जो एक ऐक्शन पोटेंशिअल उत्सर्जन करता है उसे अक्सर "फायर" करता हुआ कहा जाता है।
क्रिया विभव को कोशिका की प्लाज़्मा झिल्ली में सन्निहित विशेष प्रकार के वोल्टेज-गेटेड आयन चैनल द्वारा उत्पन्न किया जाता है।[2] इन चैनलों को तब बंद कर दिया जाता है जब झिल्ली क्षमता, कोशिका की विश्राम क्षमता के करीब होती है, लेकिन वे तेजी से खुलना शुरू हो जाते हैं जब यदि झिल्ली क्षमता सटीक रूप से परिभाषित आरंभिक मूल्य तक बढ़ जाती है। जब चैनल खुलते हैं, तो वे सोडियम आयनों के आवक की अनुमति देते हैं, जो झिल्ली क्षमता में एक आवक के प्रवाह की वृद्धि, जो परिवर्तन विद्युत-रासायनिक प्रवणता को परिवर्तित करता है, जो बदले में झिल्ली क्षमता में और वृद्धि करते हैं। इस क्रिया के परिणामस्वरूप और अधिक चैनल खुलते हैं, जो और अधिक विद्युत् धारा का उत्पादन करते हैं और इसी तरह आगे होता रहता है। यह प्रक्रिया विस्फोटक रूप से तब तक आगे बढ़ती रहती है जब तक कि सभी उपलब्ध आयन चैनल खुल नहीं जाते, जिसके फलस्वरूप झिल्ली क्षमता में एक विशाल उछाल आता है। सोडियम आयनों की तीव्र आमद, प्लाज्मा झिल्ली की ध्रुवाभिसारिता को पलट देती है और उसके बाद आयन चैनल तेज़ी से निष्क्रिय हो जाते हैं। सोडियम चैनलों के बंद होने पर, सोडियम आयन अब न्यूरॉन में प्रवेश नहीं कर सकते और वे सक्रिय रूप से प्लाज्मा झिल्ली पहुँचाया जाता है। पोटेशियम चैनल तब सक्रिय हो जाते हैं और वहां पोटेशियम आयनों की एक बाह्य धारा होती है, जो विद्युत्-रासायनिक प्रवणता को विश्राम स्थिति में वापस लाती है। एक ऐक्शन पोटेंशिअल के हो जाने के बाद, वहां एक क्षणिक नकारात्मक बदलाव होता है, जिसे अतिरिक्त पोटेशियम धाराओं के कारण आफ्टरहाइपरपोलराईजेशन या दु:साध्य अवधि कहा जाता है। यही वह क्रियावली है जो एक ऐक्शन पोटेंशिअल को उस तरीके से वापस यात्रा करने से रोकती है जिस तरीके से वह आया होता है।
पशु कोशिकाओं में, ऐक्शन पोटेंशिअल के दो मुख्य प्रकार हैं, पहला प्रकार वोल्टेज-गेटेड सोडियम चैनलों द्वारा उत्पन्न होता है और दूसरा प्रकार वोल्टेज-गेटेड कैल्शियम चैनलों द्वारा. सोडियम-आधारित ऐक्शन पोटेंशिअल आम तौर पर एक मिलीसेकंड से कम समय तक चलते हैं, जबकि कैल्शियम-आधारित ऐक्शन पोटेंशिअल 100 मिलीसेकंड या ज्यादा समय तक चल सकते हैं। कुछ प्रकार के न्यूरॉन्स में, धीमे कैल्शियम स्पाइक, तेज़ी से उत्सर्जित सोडियम स्पाइक के लम्बे विस्फोट के लिए प्रेरणा शक्ति प्रदान करते हैं। दूसरी तरफ, हृदय की मांसपेशी कोशिकाओं में, एक आरंभिक तीव्र सोडियम स्पाइक, एक कैल्शियम स्पाइक की तीव्र शुरुआत को उकसाने के लिए एक "प्राइमर" प्रदान करता है, जो तब मांसपेशी संकुचन को उत्पन्न करता है।
एक विशिष्ट न्यूरॉन के लिए अवलोकन

पशु शरीर के ऊतकों में सभी कोशिकाएं विद्युतीय रूप से ध्रुवीय होती हैं - दूसरे शब्दों में, वे कोशिका की प्लाज्मा झिल्ली के चारों ओर एक वोल्टेज भिन्नता बनाए रखती हैं, जिसे झिल्ली क्षमता (मेम्ब्रेन पोटेंशिअल) के रूप में जाना जाता है। यह विद्युतीय ध्रुवीकरण, आयन पम्प नामक झिल्ली में सन्निहित प्रोटीन संरचनाओं और आयन चैनल के बीच जटिल परस्पर क्रिया से फलित होता है। न्यूरॉन्स में, झिल्ली में आयन चैनलों के प्रकार आमतौर पर, कोशिका के विभिन्न भागों में अलग-अलग होते हैं, जो डेन्ड्राईट, अक्षतंतु और कोशिका शरीर को विभिन्न विद्युतीय गुण प्रदान करते हैं। एक परिणाम के रूप में, न्यूरॉन के झिल्ली के कुछ भाग उत्तेजनीय (ऐक्शन पोटेंशिअल पैदा करने में सक्षम) हो सकते हैं, जबकि अन्य नहीं होते हैं। न्यूरॉन का सबसे उत्तेजनीय हिस्सा आमतौर पर अक्षतंतु पहाड़ी है (बिंदु जहां अक्षतंतु कोशिका शरीर को छोड़ देता है), लेकिन अक्षतंतु और कोशिका शरीर भी अधिकांश मामलों में उत्तेजनीय होते हैं।
झिल्ली के प्रत्येक उत्तेजनीय पैच में झिल्ली क्षमता का दो महत्वपूर्ण स्तर होता है: विश्राम क्षमता, जो वह मान है जिसे झिल्ली क्षमता तब तक बनाए रखती है जब तक कोशिका को कोई चीज़ परेशान नहीं करती और एक उच्च मान जो आरंभिक क्षमता कहलाता है। एक विशिष्ट न्यूरॉन के अक्षतंतु पहाड़ी पर, विश्राम क्षमता -70 मिलीवोल्ट (mV) के आसपास होती है और आरंभिक क्षमता -55 mV के आसपास होती है। एक न्यूरॉन में सिनेप्टिक इनपुट के कारण झिल्ली विध्रुवीय या अति-ध्रुवीय हो जाती है; अर्थात वे झिल्ली क्षमता को बढ़ने या घटने के लिए प्रेरित करते हैं। ऐक्शन पोटेंशिअल तब चालू होता है जब झिल्ली क्षमता को सीमा तक लाने के लिए पर्याप्त विध्रुवण जमा हो जाता है। जब एक ऐक्शन पोटेंशिअल चालु होता है, तब झिल्ली क्षमता अचानक ऊपर की ओर उठती है, जो अक्सर +100 mV तक पहुंचती है और फिर समान रूप से अचानक वापस नीचे गिरती है, जो अक्सर विश्राम स्तर से नीचे समाप्त होती है, जहां यह कुछ समय के लिए रहती है। ऐक्शन पोटेंशिअल का आकार रूढ़िबद्ध है; अर्थात, एक दी गई कोशिका में सभी ऐक्शन पोटेंशिअल के लिए वृद्धि और गिरावट का आयाम और समयावधि, आमतौर पर लगभग समान होती है। (अपवादों की चर्चा आलेख में आगे की गई है।) अधिकांश न्यूरॉन्स में, पूरी प्रक्रिया एक सेकेण्ड के हजारवें भाग में घटती है। न्यूरॉन्स के कई रूप, प्रति सेकंड 10-100 तक की दरों से लगातार ऐक्शन पोटेंशिअल उत्सर्जित करते रहते हैं; कुछ प्रकार, हालांकि शांत होते हैं और बिना किसी ऐक्शन पोटेंशिअल के उत्सर्जन के एक मिनट या ज्यादा समय तक चल सकते हैं।
जैव-भौतिक स्तर पर, ऐक्शन पोटेंशिअल, विशेष प्रकार के वोल्टेज-गेटेड आयन चैनल से परिणामित होते हैं। झिल्ली क्षमता के बढ़ने के साथ, सोडियम आयन चैनल खुलता है, जो सोडियम आयनों को कोशिका में प्रविष्टि की अनुमति देता है। इसके बाद पोटेशियम आयन चैनल खुलते हैं जो कोशिका से पोटेशियम आयनों को बाहर निकलने की अनुमति देते हैं। सोडियम आयनों का अन्दर की ओर प्रवाह, कोशिका में धनात्मक रूप से चार्ज धनायन के संकेन्द्रण को बढ़ा देता है और विध्रुवण को प्रेरित करता है, जहां कोशिका की क्षमता, कोशिका की विश्राम क्षमता से अधिक होती है। सोडियम चैनल, ऐक्शन पोटेंशिअल के चरम पर बंद हो जाते हैं, जबकि पोटेशियम का कोशिका को छोड़ना जारी रहता है। पोटेशियम आयनों की समाप्ति, झिल्ली क्षमता को कम कर देती है या कोशिका को अति-ध्रुवीय कर देती है। विश्राम से अल्प वोल्टेज वृद्धि के लिए, पोटेशियम धारा, सोडियम धारा से अधिक हो जाती है और वोल्टेज अपने सामान्य विश्राम मान पर लौट आता है, आमतौर पर -70 mV.[3] हालांकि, अगर वोल्टेज एक महत्वपूर्ण सीमा से आगे बढ़ जाता है, आम तौर पर विश्राम मान से 15 mV अधिक, तो सोडियम धारा हावी हो जाती है। यह एक सहज स्थिति को फलित करता है जहां सोडियम धारा से आने वाली धनात्मक प्रतिक्रिया और अधिक सोडियम चैनल को सक्रिय करती है। इस प्रकार, वह कोशिका एक ऐक्शन पोटेंशिअल को उत्पन्न करते हुए "फायर" करती है।[4][5]
एक ऐक्शन पोटेंशिअल के क्रम में वोल्टेज-गेटेड चैनल के खुलने से उत्पादित होने वाली धाराएं आम तौर पर महत्वपूर्ण रूप से प्रारंभिक उत्तेजक धाराओं से बड़ी होती हैं। इस प्रकार आयाम, अवधि और ऐक्शन पोटेंशिअल का आकार काफी हद तक उत्तेजनीय झिल्ली के गुण द्वारा निर्धारित होते हैं और न कि उत्तेजना के आयाम या अवधि द्वारा. ऐक्शन पोटेंशिअल का यह ऑल-और-नथिंग गुण उसे सेट इसे क्रमिक क्षमता से अलग करता है जैसे रिसेप्टर क्षमता, इलेक्ट्रोटोनिक क्षमता और सिनेप्टिक क्षमता, जो उत्तेजना की तीव्रता के साथ बढ़ती है। विभिन्न कोशिका प्रकार और कोशिका खानों में ऐक्शन पोटेंशिअल के नाना प्रकार मौजूद होते हैं, जो वोल्टेज-गेटेड चैनलों के प्रकार, रिसाव चैनल, चैनल वितरण, आयन संकेन्द्रण, झिल्ली संधारित्र, तापमान और अन्य कारकों द्वारा निर्धारित होते हैं।
ऐक्शन पोटेंशिअल में शामिल मुख्य आयन हैं सोडियम और पोटेशियम धनायन; सोडियम आयन कोशिका में प्रवेश करते हैं और पोटेशियम आयन बाहर निकल जाते हैं और संतुलन बना रहता है। मेम्ब्रेन वोल्टेज के तीव्र बदलाव के लिए, अपेक्षाकृत कुछ आयनों को झिल्ली को पार करने की जरूरत होती है। एक ऐक्शन पोटेंशिअल के दौरान विनिमय हुए आयन, इसलिए, आंतरिक और बाह्य आयन संकेन्द्रण में एक नगण्य बदलाव करते हैं। कुछ आयन, जो वास्तव में पार कर जाते हैं वे सोडियम-पोटेशियम पंप की निरंतर क्रिया द्वारा बाहर फेंक दिए जाते हैं, जो अन्य आयन ट्रांसपोर्टर के साथ सम्पूर्ण झिल्ली में आयन संकेन्द्रण के सामान्य अनुपात को बनाए रखता है। कैल्शियम धनायन और क्लोराइड ऋणायन, ऐक्शन पोटेंशिअल के कुछ प्रकारों में शामिल हैं, उदाहरण के लिए क्रमशः हृदय संबंधी ऐक्शन पोटेंशिअल और एकल कोशिका अल्गा, एसेटाबुलारिया में ऐक्शन पोटेंशिअल.
हालांकि ऐक्शन पोटेंशिअल को स्थानीय स्तर पर उत्तेजनीय झिल्ली के पैच पर उत्पन्न किया जाता हैं, फलित होने वाली धाराएं, झिल्ली के आस-पास के फैलाव पर ऐक्शन पोटेंशिअल शुरू कर सकती हैं, जो डोमिनो के समान प्रसरण उत्पन्न कर सकते हैं। विद्युत् क्षमता (इलेक्ट्रोटोनिक पोटेंशिअल) के निष्क्रिय प्रसार के विपरीत, ऐक्शन पोटेंशिअल, झिल्ली के उत्तेजनीय फैलाव के पास नए सिरे से उत्पन्न होते हैं और बिना क्षय के फैलते हैं।[6] अक्षतंतु के मेलिन लेपित खंड उत्तेजनीय नहीं होते और वे ऐक्शन पोटेंशिअल उत्पन्न नहीं करते और संकेत, इलेक्ट्रोटोनिक पोटेंशिअल के रूप में निष्क्रिय रूप से प्रसारित होता है। नियमित अंतराल पर बिना मेलिन लेपित पैच, जिसे नोड्स ऑफ़ रैनविअर कहा जाता है, संकेत को बढ़ाने के लिए ऐक्शन पोटेंशिअल उत्पन्न करते हैं। अस्थिर संवाहन के रूप में ज्ञात, इस प्रकार का संकेत प्रसार, संकेत वेग और अक्षतंतु व्यास का एक अनुकूल समझौताकारी तालमेल प्रदान करता है। सामान्य तौर पर, अक्षतंतु टर्मिनल का विध्रुवण, सिनेप्टिक क्लेफ्ट में न्यूरोट्रांसमीटर के स्राव को प्रेरित करता है। इसके अलावा, पश्च-प्रसरण ऐक्शन पोटेंशिअल को पिरामिडीय न्यूरॉन्स के डेंड्राइट में दर्ज किया गया है, जो नियोकोर्टेक्स में सर्वत्र हैं।[7] माना जाता है कि स्पाइक-टाइमिंग-डिपेंडेंट प्लास्टिसिटी में इनकी एक भूमिका होती है।
जैव-भौतिकी और कोशिकीय सन्दर्भ
उनकी गति को प्रेरित करने वाले आयन और बल

जैविक जीवों के भीतर विद्युत संकेत, सामान्यतः, आयन द्वारा संचालित होते हैं।[9] ऐक्शन पोटेंशिअल के लिए सबसे महत्वपूर्ण धनायन, सोडियम (Na+) और पोटेशियम (K+) है।[10] दोनों ही मोनोवैलेन्ट फैटायन हैं, जो एक एकल धनात्मक चार्ज वहन करते हैं। ऐक्शन पोटेंशिअल में कैल्शियम (Ca2+)[11] भी शामिल हो सकता है, जो एक द्विसंयोजक फैटायन है जो दोहरा सकारात्मक चार्ज वहन करता है। क्लोराइड एनायन (Cl-) कुछ शैवाल के ऐक्शन पोटेंशिअल में एक बड़ी भूमिका निभाता है,[12] लेकिन अधिकांश जानवरों के ऐक्शन पोटेंशिअल में एक नगण्य भूमिका निभाता है।[13]
आयन दो प्रभाव के तहत कोशिका झिल्ली को पार करते हैं: विसरण और विद्युत् क्षेत्र. एक सरल उदाहरण जिसमें दो विलय -A और B- को एक छिद्रदार बाधा से अलग करना यह व्याख्या करता है कि विसरण यह सुनिश्चित करेगा कि वे अंततः समान विलय में मिश्रित हो जायेंगे. यह मिश्रण, उनके संकेन्द्रण में अंतर की वजह से होता है। उच्च संकेन्द्रण वाला क्षेत्र, निम्न संकेन्द्रण वाले क्षेत्र की ओर विसरित हो जायेगा. उदाहरण का विस्तार करने के लिए, मान लेते हैं कि विलय A में 30 सोडियम आयन और 30 क्लोराइड आयन हैं। इसके अलावा, मान लेते हैं कि विलय B में केवल 20 सोडियम आयन और 20 क्लोराइड आयन हैं। यह मान कर कि बाधा, दोनों प्रकार के आयनों को गुज़रने देती है, तब एक स्थिर स्थिति पर पहुंचा जाता है जहां दोनों विलय के पास 25 सोडियम आयन और 25 क्लोराइड आयन होते हैं। हालांकि, अगर छिद्रदार बाधा इस बात पर चयनात्मक हो कि किस आयन को गुजरने दिया जाए, तो अकेले विसरण, फलित विलय को निर्धारित नहीं करेगा। पिछले उदाहरण पर लौटते हुए, एक ऐसी बाधा बनाते हैं जो केवल सोडियम आयनों द्वारा पारगम्य हैं। चूंकि विलय B में सोडियम और क्लोराइड, दोनों का न्यून संकेन्द्रण है, वह बाधा विलय से दोनों आयनों को आकर्षित करेगी। हालांकि, केवल सोडियम बाधा के माध्यम से यात्रा करेंगे। इससे विलय B में सोडियम का एक संचय फलित होगा। चूंकि सोडियम में एक धनात्मक चार्ज है, यह संचय विलय B को विलय A की अपेक्षा अधिक धनात्मक बनाएगा. धनात्मक सोडियम आयन के, अब अधिक-धनात्मक बन चुके विलय B तक यात्रा करने की संभावना कम होगी। इससे आयन प्रवाह को नियंत्रित करने वाले दूसरे कारक का निर्माण होता है, अर्थात् विद्युत् क्षेत्र. वह बिंदु जहां यह विद्युत् क्षेत्र विसरण के कारण बल का पूरी तरह से विरोध करता है उसे संतुलन क्षमता कहा जाता है। इस बिंदु पर, इस विशिष्ट आयन (इस मामले में सोडियम) का शुद्ध प्रवाह शून्य है।
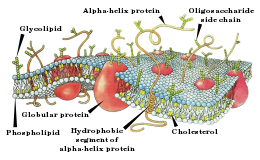
कोशिका झिल्ली
प्रत्येक न्यूरॉन एक कोशिका झिल्ली में लिपटा होता है जो एक फोस्फोलिपिड बाइलेयर से बनी होती है। यह झिल्ली आयन के लिए लगभग अभेद्य होती है।[14] आयनों को न्यूरॉन के बाहर और अन्दर अंतरण के लिए, झिल्ली दो संरचनाओं को प्रदान करती है। आयन पंप, आयनों को लगातार अन्दर और बाहर करने के लिए कोशिका की ऊर्जा का उपयोग करते हैं। वे आयनों को अपने संकेन्द्रण प्रवणता के खिलाफ भेजकर (न्यून संकेन्द्रण के क्षेत्रों से उच्च संकेन्द्रण के क्षेत्रों के लिए), संकेन्द्रण भिन्नता का निर्माण करते हैं (न्यूरॉन के अंदर और बाहर)। आयन चैनल तब इस संकेन्द्रण भिन्नता का उपयोग आयानों को अपने संकेन्द्रण प्रवणता के नीचे भेजने के लिए करते हैं (उच्च संकेन्द्रण के क्षेत्रों से न्यून संकेन्द्रण के क्षेत्रों की तरफ)। हालांकि, आयन पंपों द्वारा सतत परिवहन के विपरीत, आयन चैनलों द्वारा परिवहन असतत है। वे सिर्फ अपने परिवेश के संकेतों की प्रतिक्रिया में खुलते और बंद होते हैं। आयन चैनलों के माध्यम से आयनों का यह परिवहन तब कोशिका झिल्ली के वोल्टेज को बदलता है। यही परिवर्तन हैं जो एक ऐक्शन पोटेंशिअल को लाते हैं। एक सादृश्य के रूप में, आयन पंप उस बैटरी की भूमिका निभाते हैं जो एक रेडियो सर्किट (आयन चैनलों) को एक संकेत (ऐक्शन पोटेंशिअल) संचारित करने के लिए अनुमति देते हैं।[15]

झिल्ली क्षमता (मेम्ब्रेन पोटेंशिअल)
कोशिका झिल्ली उस बाधा के रूप में कार्य करती है जो अंदर के विलय (अंतरकोशिकीय द्रव) को बाहर के विलय (बाह्यकोशिकीय द्रव) से मिश्रित होने से रोकती है। इन दो विलयों में उनके आयनों का भिन्न संकेन्द्रण है। इसके अलावा, संकेन्द्रण में यह अंतर, विलय के चार्ज में भिन्नता को फलित करता है। इससे एक ऐसी परिस्थिति पनपती है जहां एक विलय दूसरे विलय से अधिक धनात्मक होता है। इसलिए, धनात्मक आयन, ऋणात्मक विलय की दिशा में खिंचने लगते हैं। इसी तरह, ऋणात्मक आयन, धनात्मक विलय की दिशा में खिंचने लगते हैं। इस गुण के मापन के लिए, एक व्यक्ति किसी भी तरह इस सापेक्ष धनात्मकता (या ऋणात्मकता) को पकड़ना चाहेगा. यह करने के लिए, बाहर के विलय को शून्य वोल्टेज के रूप में सेट किया जाता है। तब अंदरूनी वोल्टेज और शून्य वोल्टेज के बीच अंतर निर्धारित होता है। उदाहरण के लिए, यदि बाहरी वोल्टेज 100 mV है और अंदरूनी वोल्टेज 30 mV है, तो अंतर -70 mV है। यही अंतर है जिसे सामान्यतः झिल्ली क्षमता के रूप में सन्दर्भित किया जाता है।
आयन चैनल
आयन चैनल, अभिन्न झिल्ली प्रोटीन होते हैं जिसमें एक छेद होता है जिसमें से आयन, बाह्य कोशिकीय स्थान और आंतरिक कोशिका के बीच यात्रा कर सकते हैं। ज्यादातर चैनल एक आयन के लिए विशिष्ट (चयनात्मक) होते हैं; उदाहरण के लिए, सोडियम की तुलना में पोटेशियम के लिए अधिकांश पोटेशियम चैनल 1000:1 चयनात्मकता अनुपात से चरितार्थ होते हैं, हालांकि पोटेशियम और सोडियम आयनों में एक ही चार्ज होता है और वे केवल अपनी त्रिज्या में थोड़ा भिन्न होते हैं। चैनल छिद्र आम तौर पर इतना छोटा होता है कि आयनों को इसमें से एकल-फ़ाइल क्रम के अनुसार गुजरना आवश्यक होता है।[17][18] आयन मार्ग के लिए चैनल छिद्र या तो खुले या बंद हो सकते हैं, हालांकि कई चैनल, विभिन्न उप चालकता स्तर को प्रदर्शित करते हैं। जब एक चैनल खुला होता है, तो आयन, उस विशेष आयन के लिए चैनल छिद्र के माध्यम से नीचे ट्रांसमेम्ब्रेन संकेन्द्रण प्रवणता में घुस जाते हैं। चैनल के माध्यम से आयन प्रवाह दर, अर्थात्, एकल-चैनल विद्युत् आयाम, अधिकतम चैनल चालकता और उस आयन के लिए विद्युत्-रासायनिक प्रेरण बल द्वारा निर्धारित होता है, जो झिल्ली क्षमता के तात्कालिक मान और विपरीत क्षमता के मान के बीच का अंतर है।[19]
ऐक्शन पोटेंशिअल, विभिन्न समय पर खुलते और बंद होते विभिन्न आयन चैनलों का प्रकटीकरण है।[20]

एक चैनल की कई विभिन्न अवस्थाएं हो सकती हैं (प्रोटीन की विभिन्न रचना के अनुसार), लेकिन प्रत्येक ऐसी अवस्था या तो बंद है या खुली. सामान्य रूप से, बंद अवस्था या तो छिद्र के एक संकुचन के अनुरूप होगी - इसे आयन के लिए अगम्य बनाते हुए - या छिद्र को रोकते हुए प्रोटीन के एक अलग हिस्से के अनुरूप. उदाहरण के लिए, वोल्टेज-निर्भर सोडियम चैनल निष्क्रियता से गुज़रता है, जिसमें प्रोटीन का एक भाग छिद्र में सरक जाता है और उसे बंद कर देता है।[21] यह निष्क्रियता, सोडियम धरा को बंद कर देती है और ऐक्शन पोटेंशिअल में एक महत्वपूर्ण भूमिका निभाती है।
आयन चैनलों को इस बात के आधार पर वर्गीकृत किया जा सकता है कि वे अपने परिवेश के खिलाफ कैसे प्रतिक्रिया देते हैं।[22] उदाहरण के लिए, ऐक्शन पोटेंशिअल में शामिल आयन चैनल हैं वोल्टेज-सेंसिटिव चैनल ; वे सम्पूर्ण झिल्ली में वोल्टेज के खिलाफ प्रतिक्रिया में खुलते और बंद होते हैं। लिगेंड-गेटेड चैनल एक अन्य महत्वपूर्ण वर्ग का निर्माण करते हैं; ये आयन चैनल लिगेंड अणु के बंधन के लिए प्रतिक्रियास्वरूप खुलते और बंद होते हैं, जैसे न्यूरोट्रांसमीटर. अन्य आयन चैनल, यांत्रिक बलों के साथ खुलते और बंद होते हैं। अभी भी अन्य आयन चैनल - जैसे कि संवेदी न्यूरॉन वाले - अन्य उद्दीपनों के खिलाफ प्रतिक्रिया में खुलते और बंद होते हैं, जैसे प्रकाश, तापमान या दबाव.
आयन पंप
ऐक्शन पोटेंशिअल की आयनिक धारा, सम्पूर्ण कोशिका झिल्ली में आयन के संकेन्द्रण भिन्नता की प्रतिक्रिया में प्रवाहित होती है। ये संकेन्द्रण भिन्नताएं आयन पंपों द्वारा स्थापित की जाती हैं, जो अभिन्न झिल्ली प्रोटीन हैं जो सक्रिय परिवहन संचालित करती हैं, अर्थात आयन को उनके संकेन्द्रण प्रवणता के खिलाफ पम्प करने के लिए कोशिकीय ऊर्जा (ATP) का उपयोग करती हैं।[23] ऐसे आयन पंप, आयनों को झिल्ली के एक पक्ष से लेते हैं (उनके संकेन्द्रण को वहां कम करते हुए) और उन्हें दूसरे पक्ष में छोड़ते हैं (वहां उनके संकेन्द्रण को बढ़ाते हुए)। ऐक्शन पोटेंशिअल के लिए सबसे अधिक प्रासंगिक आयन पंप है सोडियम-पोटेशियम पंप, जो कोशिका से तीन सोडियम आयनों को बाहर करता है दो पोटेशियम आयनों को अन्दर करता है।[24] परिणामस्वरूप, न्यूरॉन के अंदर पोटेशियम आयनों K+ का संकेन्द्रण बाहर के संकेन्द्रण की तुलना में मोटे तौर पर 20 गुना अधिक होता है, जबकि बाहर का सोडियम संकेन्द्रण अन्दर की अपेक्षा लगभग नौ गुना बड़ा होता है।[25][26] ठीक इसी तरीके से, अन्य आयनों में न्यूरॉन के अन्दर और बाहर भिन्न संकेन्द्रण होता है, जैसे कैल्शियम, क्लोराइड और मैग्नीशियम.[26]
आयन पंप, अंतरकोशिकीय और बाह्य कोशिकीय आयन संकेन्द्रण के सापेक्ष अनुपात की स्थापना द्वारा ही ऐक्शन पोटेंशिअल क्षमता प्रभावित करते हैं। ऐक्शन पोटेंशिअल में मुख्य रूप से आयन चैनलों का, न कि आयन पंपों का खुलना और बंद होना शामिल होता है। अगर आयन पंपों को बंद करने के लिए उनके ऊर्जा स्रोत को हटा दिया जाए, या वाबेन जैसे अवरोध को जोड़ दिया जाए, तो उस स्थिति में भी अक्षतंतु अपने आयाम के तेज़ी से क्षय होने से पहले सैकड़ों हज़ार ऐक्शन पोटेंशिअल को फायर कर सकता है।[23] विशेष रूप से, आयन पंप, एक ऐक्शन पोटेंशिअल के बाद झिल्ली के पुनः ध्रुवीकरण में कोई महत्वपूर्ण भूमिका नहीं निभाते। [10]
विश्राम क्षमता (रेस्टिंग पोटेंशिअल)
जैसा कि उनकी गति को प्रेरित करने वाले आयन और बल खंड में वर्णित है, एक आयन की संतुलन या उलटाव क्षमता ट्रांसमेम्ब्रेन वोल्टेज का वह मान है जिस पर आयन के विसरण गतिविधि द्वारा उत्पन्न विद्युत् बल, उसके संकेन्द्रण प्रवणता के नीचे उस विसरण के आणविक बल के बराबर हो जाते हैं। किसी भी आयन के लिए संतुलन क्षमता को नर्न्स्ट समीकरण का उपयोग करते हुए परिकलित किया जा सकता है।[27][28] उदाहरण के लिए, पोटेशियम आयनों के लिए पलटाव क्षमता निम्नानुसार होगा
जहां:
- E eq,K+ पोटेशियम के लिए संतुलन क्षमता है जिसे वोल्ट में मापा जाता है
- R सार्वभौमिक गैस कौनस्टेन्ट, जो 8.314 J·K−1·mol−1 के बराबर है
- T निरपेक्ष तापमान है, जिसे केल्विन में मापा जाता है (केल्विन में तापमान डिग्री सेल्सिअस + 273.15 के बराबर होता है)
- z अभिक्रिया में शामिल प्रश्न में आयन के प्राथमिक चार्ज की संख्या है
- F फैराडे कौनस्टेन्ट है, जो 96,485 C·mol−1 या J·V−1·mol−1
- [K+]o पोटेशियम का बाह्यकोशिकीय संकेन्द्रण है, जिसे mol·m−3 या mmol·l−1 में मापा जाता है
- [K+]i पोटेशियम का अंतरकोशिकीय संकेन्द्रण है।
भले ही दो भिन्न आयनों में एक ही चार्ज है (अर्थात् K+ और Na+), उनमें फिर भी बिलकुल भिन्न संतुलन क्षमता हो सकती है, बशर्ते कि उनका बाह्य और/या प्रदान की संकेन्द्रण के बाहर उनके और / या अंदर अलग. उदाहरण के लिए, न्यूरॉन्स में पोटेशियम और सोडियम की संतुलन क्षमता. पोटेशियम संतुलन क्षमता E k, -84 mV है जहां 5 mmol/L पोटेशियम बाहर और 140 mmol/L अंदर है। दूसरी ओर, सोडियम संतुलन क्षमता E Na लगभग +40 mV है जहां 1-2 mmol/L सोडियम अंदर और 120 mmol/L बाहर है।[note 1]
हालांकि, वहां एक संतुलन झिल्ली क्षमता E m होती है जिस पर सम्पूर्ण झिल्ली पर सभी आयनों का शुद्ध प्रवाह शून्य होता है। इस क्षमता की गणना गोल्डमैन समीकरण के द्वारा की जाती है।[29][30] संक्षेप में, यह नर्न्स्ट समीकरण है, इस मायने में कि यह सवाल वाले आयन के चार्ज पर आधारित है, साथ ही साथ उनके बाहर और अन्दर के संकेन्द्रण के बीच की भिन्नता पर भी. हालांकि, यह प्रश्न में प्रत्येक आयन के लिए प्लाज्मा झिल्ली की सापेक्ष पारगम्यता पर भी विचार करता है।
ऐक्शन पोटेंशिअल के सबसे महत्वपूर्ण तीन मोनोवैलेन्ट आयन के लिए: पोटेशियम (K+), सोडियम (Na+) और क्लोराइड (Cl-)। एक एनायन होने के नाते, क्लोराइड पदों के साथ फैटियन पदों से अलग व्यवहार किया जाता है; अंदर का संकेन्द्रण अंश है और बाहर का संकेन्द्रण हर है, जो फैटियन शब्दों से उलट है। P i , i प्रकार के आयन के पारगम्यता के लिए है। अगर कैल्शियम आयनों पर भी विचार किया जाए, जो मांसपेशियों में ऐक्शन पोटेंशिअल के लिए महत्वपूर्ण हैं, तो संतुलन क्षमता के लिए सूत्र और अधिक जटिल हो जाता है।[31]
विश्राम झिल्ली क्षमता की उत्पत्ति को स्पष्ट रूप से गोल्डमैन समीकरण द्वारा समझाया जा सकता है। अधिकांश पशु कोशिकाओं की विश्राम प्लाज्मा झिल्ली K+ के प्रति अधिक पारगम्य है, जो विश्राम क्षमता V rest को पोटेशियम संतुलन क्षमता के नज़दीक करता है।[32][33][34]
यह जानना महत्वपूर्ण है कि शुद्ध लिपिड द्विपरत की आयनिक और जल पारगम्यता बहुत न्यून है और यह समान तरीके से, तुलनीय आकार का आयनों के लिए नगण्य हैं, जैसे Na+ K+। हालांकि, कोशिका झिल्लियां, बड़ी संख्या में आयन चैनल, जल चैनल (एक्वापोरीन) और विभिन्न आयनिक पंपों, एक्सचेंजर और ट्रांसपोर्टरों को धारण करती हैं जो नाटकीय और चुनिंदा रूप से विभिन्न आयनों के लिए झिल्ली की पारगम्यता को बढ़ाती हैं। विश्राम क्षमता पर पोटेशियम आयन के लिए अपेक्षाकृत उच्च झिल्ली पारगम्यता, अंदरूनी-संशोधक पोटाशियम आयन चैनल से फलित होती है, जो ऋणात्मक वोल्टेज पर खुली होती है, तथाकथित लीक पोटेशियम कंडक्टेन्सेस जैसे मुक्त संशोधक K+ चैनल (ORK+) जो खुली स्थिति में बंद किये गए होते हैं। इन पोटेशियम चैनलों को वोल्टेज-सक्रिय K+ से भिन्न समझा जाना चाहिए जो ऐक्शन पोटेंशिअल के दौरान झिल्ली पुनर्ध्रुविकरण के लिए जिम्मेदार होते हैं।

न्यूरॉन की रचना
कई प्रकार की कोशिकाएं ऐक्शन पोटेंशिअल का समर्थन करती हैं, जैसै पौध कोशिका, मांसपेशिय कोशिका और हृदय की विशेष कोशिकाएं (जिसमें हृद्जन्य ऐक्शन पोटेंशिअल घटित होता है)। हालांकि, मुख्य उत्तेजनीय कोशिका न्यूरॉन है, जिसमें ऐक्शन पोटेंशिअल के लिए सबसे आसान तंत्र भी है।
न्यूरॉन्स, विद्युतीय रूप से उत्तेजनीय कोशिका हैं जो अक्षतंतु अधिक सामान्य, के एक या एक से अधिक डेन्ड्राईट, एक एकल सोमा, एक एकल अक्षतंतु और एक या अधिक अक्षतंतु टर्मिनलों से बना होता है। डेन्ड्राइट, दो प्रकार के सिनैप्सेस में से एक है, दूसरा प्रकार अक्षतंतु टर्मिनल बोटंस है। डेन्ड्राइट, अक्षतंतु टर्मिनल बोटंस के प्रतिक्रिया में उत्क्षेपण का गठन करते हैं। इन उत्क्षेपण, या शूल को, प्रीसिनेप्टिक न्यूरॉन द्वारा जारी न्यूरोट्रांसमीटर पर कब्जा करने के लिए डिजाइन किया गया है। उनमें लिगेंड द्वारा सक्रिय चैनल का एक उच्च संकेन्द्रण होता है। इसलिए यही वह जगह है जहां पर दो न्यूरॉन्स से सिनेप्सेस एक दूसरे के साथ संवाद करते हैं। इन शूलों में एक पतली गर्दन होती है जो एक बल्बनुमा उत्क्षेपण को मुख्य डेन्ड्राइट से जोड़ती है। इससे यह सुनिश्चित होता है कि जो परिवर्तन रीढ़ के अंदर हो रहे हैं उनके द्वारा आस-पास की रीढ़ को प्रभावित करने की कम संभावना है। इसलिए दुर्लभ अपवाद (LTP देखें) के साथ डेन्ड्राइट के समान रीढ़, एक स्वतंत्र इकाई के रूप में कार्य करती है। इसके बाद डेन्ड्राइट, सोमा से जुड़ता है। सोमा, केन्द्रक को धारण करता है, जो न्यूरॉन के लिए नियामक के रूप में काम करता है। रीढ़ के विपरीत, सोमा की सतह वोल्टेज द्वारा सक्रिय आयन चैनलों से व्याप्त है। ये चैनल, डेन्ड्राइट द्वारा उत्पन्न संकेतों को संचारित करने में मदद करते हैं। सोमा से अक्षतंतु गिरिका बाहर निकलती है। यह क्षेत्र, वोल्टेज द्वारा सक्रिय सोडियम चैनल के एक अविश्वसनीय उच्च संकेन्द्रण धारण करने से चरितार्थ होता है। सामान्य रूप में, ऐक्शन पोटेंशिअल के लिए इसे स्पाइक आरम्भ क्षेत्र माना जाता है।[35] रीढ़ पर उत्पन्न और सोमा द्वारा संचरित एकाधिक संकेत, सभी यहां अभिसरित होते हैं। अक्षतंतु गिरिका के तुरंत बाद अक्षतंतु है। यह एक पतली बेलनाकार उत्क्षेपण है जो सोमा से दूर यात्रा करती है। यह अक्षतंतु एक मेलिन खोल द्वारा पृथक होता है। मेलिन, श्वान कोशिका से बना है जो अक्षतन्तु खंड के इर्द-गिर्द कई बार खुद को लपेटती है। इससे एक मोटी वसा की परत बनती है जो आयनों को अक्षतंतु में प्रवेश करने या भागने से रोकता है। यह अलगाव दोनों कार्य करता है, महत्वपूर्ण संकेत क्षय को रोकता है और साथ ही साथ तीव्र संकेत गति को सुनिश्चित करता है। हालांकि, इस अलगाव में यह प्रतिबंध है कि अक्षतंतु की सतह पर कोई भी चैनल उपस्थित नहीं हो सकता है। इसलिए, झिल्ली के नियमित धब्बे हैं, जिनमें कोई अलगाव नहीं है। इन रैनविअर के नोड्स को 'लघु अक्षतंतु गिरिका' माना जा सकता है क्योंकि उनका उद्देश्य अत्यधिक संकेत क्षय को रोकने के लिए संकेत को बढ़ाना है। अंतिम छोर पर, अक्षतंतु अपने रोधन को खो देता है और कई अक्षतंतु टर्मिनलों में फ़ैलने लगता है। ये अक्षतंतु टर्मिनल तब दूसरे वर्ग के सिनेप्सेस, अक्षतंतु टर्मिनल बटन के गठन के लिए समाप्त होता है। इन बटन में वोल्टेज द्वारा सक्रिय कैल्शियम चैनल होते हैं, जो अन्य न्यूरॉन्स को संकेत देने के समय भूमिका निभाते हैं।
| Neuron |
|---|
आरम्भ
अक्षतंतु के आस-पास ऐक्शन पोटेंशिअल का प्रसार और सिनेप्टिक नौब में समाप्ति पर विचार करने से पहले, उन तरीकों पर विचार करना लाभदायक होता है जिनके द्वारा अक्षतंतु गिरिका पर ऐक्शन पोटेंशिअल को आरंभ किया जा सकता है। बुनियादी आवश्यकता यह है कि गिरिका पर झिल्ली वोल्टेज को फायरिंग के लिए सीमा से ऊपर उठाया जाना चाहिए। [36] ऐसे कई तरीके हैं जिसमें यह विध्रुवण हो सकता है।

तंत्रिकासंचरण
ऐक्शन पोटेंशिअल, सबसे आम रूप से प्रीसिनेप्टिक न्यूरॉन से उत्तेजक पोस्टसिनेप्टिक पोटेंशिअल द्वारा शुरू किये जाते हैं।[37] आमतौर पर, तंत्रिकासंचारक अणु, प्रीसिनेप्टिक न्यूरॉन द्वारा जारी किये जाते हैं। ये तंत्रिकासंचारक इसके बाद पोस्टसिनेप्टिक कोशिका पर रिसेप्टर्स से बंध जाते है। यह बाइंडिंग, विभिन्न प्रकार के आयन चैनल को खोलती है। खोलने की इस प्रक्रिया के चलते कोशिका झिल्ली की स्थानीय पारगम्यता में परिवर्तन का प्रभाव फलित होता है और जिससे झिल्ली क्षमता में बदलाव आता है। यदि बाइंडिंग से वोल्टेज बढ़ जाता है (झिल्ली का विध्रुवण होता है) तो सिनेप्स उत्तेजक होता है। हालांकि, अगर यह बंधन वोल्टेज को कम कर देता है (झिल्ली का उच्च ध्रुवण होता है) तो यह निरोधात्मक होता है। वोल्टेज कम हो या बढ़े, यह परिवर्तन झिल्ली के आस-पास के क्षेत्रों में निष्क्रिय रूप से प्रसारित होता है (जैसा कि केबल समीकरण और इसके शोधन द्वारा वर्णित है)। आमतौर पर, वोल्टेज उद्दीपन, सिनेप्स से दूर होते हुए और तंत्रिकासंचारक के बंधन से समय के साथ घातांकीय रूप से क्षय होता है। उद्दीपन वोल्टेज का कुछ अंश अक्षतंतु गिरिका तक पहुंच सकता है और (दुर्लभ मामलों में) झिल्ली का इतना विध्रुवण करता है कि एक नया ऐक्शन पोटेंशिअल प्रेरित होता है। आम तौर पर कई सिनेप्सेस की उत्तेजक क्षमता को एक नए ऐक्शन पोटेंशिअल को प्रेरित करने के लिए एक ही समय में एक साथ काम करना चाहिए। उनके संयुक्त प्रयास को काउंटर-एक्टिंग निरोधात्मक पोस्टसिनेप्टिक पोटेंशिअल द्वारा नाकाम किया जा सकता है।
तंत्रिकासंचरण विद्युतीय सिनेप्सेस के माध्यम से भी हो सकता है।[38] गैप जंक्शन के रूप में एक उत्तेजनीय कोशिका के बीच सम्बन्ध के कारण, एक ऐक्शन पोटेंशिअल को एक कोशिका से दूसरी कोशिका में सीधे प्रसारित किया जा सकता है। कोशिकाओं के बीच आयनों का मुक्त प्रवाह, तीव्र गैर-रासायनिक मध्यस्थता संचरण को सक्षम बनाता है। सुधार चैनल यह सुनिश्चित करते हैं कि ऐक्शन पोटेंशिअल एक विद्युत सिनेप्स के माध्यम से एक ही दिशा में चलते हैं। मानव तंत्रिका प्रणाली में इस प्रकार का सिनेप्स हालांकि असामान्य है। []
"ऑल-और-नन" सिद्धांत
ऐक्शन पोटेंशिअल का आयाम, उसे उत्पन्न करने वाले विद्युत् की राशि से स्वतन्त्र होता है। दूसरे शब्दों में, बड़ी धारा बड़ा ऐक्शन पोटेंशिअल पैदा नहीं करती. इसलिए ऐक्शन पोटेंशिअल को ऑल-और-नन (या बुलियन) कहा जाता है, क्योंकि वे या तो पूरी तरह मौजूद होते हैं या बिल्कुल मौजूद नहीं होते. इसके बजाय, ऐक्शन पोटेंशिअल की आवृत्ति ही एक उद्दीपन की तीव्रता के लिए कूटीत करता है। यह रिसेप्टर पोटेंशियल के विपरीत है जिसका आयाम एक उद्दीपन की तीव्रता पर निर्भर होता है।[15]
संवेदी न्यूरॉन्स
संवेदी न्यूरॉन्स में एक बाहरी सिग्नल जैसे दबाव, तापमान, प्रकाश या ध्वनि आयन चैनल के खुलने और बंद होने के साथ सम्मिलित होता है, जो बदले में झिल्ली और उसके वोल्टेज की आयनिक पारगम्यता को कम करता है।[39] यह वोल्टेज परिवर्तन फिर उत्तेजक (विध्रुवण) या निरोधमय (उच्चध्रुवण) हो सकता है और कुछ संवेदी न्यूरॉन्स में, उनका संयुक्त प्रभाव अक्षतंतु गिरिका को ऐक्शन पोटेंशिअल को प्रेरित करने के लिए पर्याप्त विध्रुवित कर सकता है। मानवों में उदाहरण के रूप में शामिल है ओलफैक्टरी रिसेप्टर न्यूरॉन और माइस्नर कणिका जो क्रमशः गंध और स्पर्श की भावना के लिए महत्वपूर्ण है। हालांकि, सभी संवेदी न्यूरॉन्स अपने बाह्य संकेतों को ऐक्शन पोटेंशिअल में नहीं बदलते; कुछ में यहां तक कि अक्षतंतु भी नहीं होता![40] इसके बजाय, वे संकेत को एक तंत्रिकासंचारक को जारी करने में या सतत वर्गीकृत क्षमता में परिवर्तित कर सकते हैं, दोनों में कोई भी बाद के न्यूरॉन को एक ऐक्शन पोटेंशिअल को फायर करने के लिए प्रेरित कर सकता है। उदाहरण के लिए, मानव कान में, केश कोशिका के अणु, आवक ध्वनि को यांत्रिक रूप से चालित आयन चैनल के खुलने और बंद होने में परिवर्तित करते हैं, जो तंत्रिकासंचारक अणु के जारी होने का कारण बन सकता है। ऐसे ही समान तरीके से, मानव रेटिना में, प्रारंभिक फोटोरिसेप्टर कोशिका और कोशिका की अगली दो परत (द्विध्रुवी कोशिका और क्षैतिज कोशिका) ऐक्शन पोटेंशिअल का उत्पादन नहीं करती; केवल कुछ अमेक्रीन कोशिका और तीसरी परत, नाड़ीग्रन्थि कोशिका, ऐक्शन पोटेंशिअल का उत्पादन करती है, जो ऑप्टिक तंत्रिका तक यात्रा करती है।
पेसमेकर पोटेंशियल
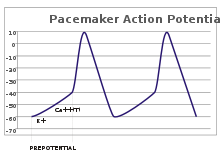
संवेदी न्यूरॉन्स में, ऐक्शन पोटेंशिअल एक बाह्य प्रेरणा से फलित होते हैं। हालांकि, कुछ उत्तेजनीय कोशिकाओं को फायर करने के लिए ऐसी किसी प्रेरणा की कोई आवश्यकता नहीं होती है: वे अपने अक्षतंतु गिरिका को स्वतः ही विध्रुवित करते हैं और एक नियमित दर से एक आंतरिक लॉक की तरह ऐक्शन पोटेंशिअल फायर करते हैं।[41] ऐसी कोशिकाओं के वोल्टेज निशान को पेसमेकर पोटेंशिअल के रूप में जाना जाता है।[42] ह्रदय में सीनोंएट्रिअल नोड की कार्डियक पेसमेकर कोशिका एक अच्छा उदाहरण प्रदान करती है।[43] हालांकि ऐसे पेसमेकर पोटेंशिअल में एक प्राकृतिक लय होती है, इसे बाहरी प्रेरक द्वारा समायोजित किया जा सकता है; उदाहरण के लिए, हृदय दर को फार्मास्यूटिकल्स द्वारा बदला जा सकता है और साथ ही साथ सिम्पेथेटिक और पैरासिम्पेथेटिक तंत्रिकाओं के संकेतों से भी.[44] बाह्य प्रेरक, कोशिका की दोहरावदार फायरिंग को परिणामित नहीं करते बल्कि केवल उसके समय को बदल देते हैं।[42] कुछ मामलों में, फ्रीक्वेंसी का विनियमन अधिक जटिल हो सकता है, जो ऐक्शन पोटेंशिअल के पैटर्न को सामने लाता है, जैसे बर्स्टिंग.
चरण
ऐक्शन पोटेंशिअल के पथ को पांच भागों में विभाजित किया जा सकता है: विकास चरण, चरम चरण, पतन चरण, अंडरशूट चरण और अंत में दु:साध्य अवधि. विकास चरण में झिल्ली क्षमता विध्रुवित होती है (अधिक धनात्मक हो जाती है)। जिस बिंदु पर विध्रुवण बंद हो जाता है वह चरम चरण (पीक फेज़) कहलाता है। इस स्तर पर, झिल्ली क्षमता अधिकतम हो जाती है। इसके बाद, एक गिरावट का चरण आता है। इस चरण में झिल्ली क्षमता उच्च विध्रुवित होती है (अधिक ऋणात्मक हो जाती है)। अंडरशूट चरण वह बिंदु है जिसके दौरान झिल्ली क्षमता, विश्राम के समय की तुलना में अस्थायी रूप से अधिक ऋणात्मक चार्ज हो जाती है। अंत में, वह समय जिसके दौरान एक बाद के ऐक्शन पोटेंशिअल को फायर करना असंभव या मुश्किल हो जाता है उसे दु:साध्य अवधि कहा जाता है, जो अन्य चरणों के साथ अतिव्याप्त हो सकता है।[45]
ऐक्शन पोटेंशिअल का पथ, दो युग्मित प्रभावों द्वारा निर्धारित होता है।[46] वोल्टेज के प्रति संवेदनशील प्रथम आयन चैनल, झिल्ली वोल्टेज V m में होने वाले परिवर्तन की प्रतिक्रिया में खुलते और बंद होते हैं। इससे उन आयनों के प्रति झिल्ली की पारगम्यता बदल जाती है।[47] दूसरा, गोल्डमैन समीकरण के अनुसार, पारगम्यता में यह परिवर्तन संतुलन क्षमता E m में बदल जाता है और इस प्रकार, झिल्ली वोल्टेज V m में.[30] इस प्रकार, झिल्ली क्षमता, पारगम्यता को प्रभावित करती है, जो फिर आगे की झिल्ली क्षमता को प्रभावित करता है। इससे सकारात्मक प्रतिक्रिया की संभावना निर्धारित होती है, जो ऐक्शन पोटेंशिअल के विकास चरण का एक मुख्य हिस्सा है।[4] एक जटिल पहलू यह है कि एक एकल आयन चैनल में बहु आंतरिक "गेट" हो सकते हैं जो विपरीत तरीकों से V m में परिवर्तन की प्रतिक्रिया करते हैं।[48][49] उदाहरण के लिए, यद्यपि बढ़ता V m , वोल्टेज के प्रति संवेदनशील सोडियम चैनल में अधिकांश गेट को खोलता है, वह, चैनल के निष्क्रियता गेट को भी बंद करता है, हालाँकि थोड़ा धीरे करता है।[50] इसलिए, जब Vm को अचानक उठाया जाता है, तो सोडियम चैनल शुरू में खुल जाते हैं, लेकिन फिर धीमी निष्क्रियता के कारण बंद हो जाते हैं।
ऐक्शन पोटेंशिअल के वोल्टेज और करेंट को उसके सभी चरणों में एलन लॉयड हौज्गिन और एंड्रयू हक्सले द्वारा 1952 में सटीक रूप से चित्रित किया गया था,[49] जिसके लिए उन्हें 1963 में फिजियोलॉजी या चिकित्सा में नोबेल पुरस्कार से सम्मानित किया गया।[51] हालांकि, उनका मॉडल केवल दो प्रकार के वोल्टेज संवेदनशील आयन चैनलों पर विचार करता है और उनके बारे में कई धारणाएं बनाता है, जैसे कि उनके आंतरिक द्वार एक दूसरे से स्वतंत्र रूप में खुलते और बंद होते हैं। वास्तविकता में, आयन चैनलों के कई प्रकार होते हैं,[22] और वे एक दूसरे से स्वतंत्र रूप में हमेशा खुलते और बंद नहीं होते हैं।[52]
उद्दीपन और विकास चरण
एक ठेठ ऐक्शन पोटेंशिअल, एक पर्याप्त मजबूत विध्रुवण के साथ अक्षतंतु गिरिका[53] पर शुरू होती है, जैसे एक प्रेरक जो बढ़ जाता है। यह विध्रुवण, कोशिका में अक्सर अतिरिक्त सोडियम कटियन के इंजेक्शन के कारण पैदा होता है; ये फैटायन एक व्यापक किस्म के स्रोतों से आ सकते हैं, जैसे रासायनिक सिनेप्सेस, संवेदी न्यूरॉन या पेसमेकर पोटेंशिअल से.
पोटेशियम के लिए प्रारंभिक झिल्ली पारगम्यता कम होती है, लेकिन अन्य आयनों से अधिक होती है, जो रेस्टिंग पोटेंशिअल को E K≈-75 mV के नज़दीक बना देती है।[32] यह विध्रुवण, झिल्ली में सोडियम और पोटेशियम, दोनों चैनलों को खोलता है और आयनों को क्रमशः अक्षतंतु के अन्दर और बाहर प्रवाहित होने की अनुमति देता है। अगर विध्रुवण छोटा है (मान लीजिये, V m को -70 mV से बढ़ाते हुए -60 mV करना) बाहर जाती पोटेशियम धारा आवक सोडियम धरा को अभिभूत कर देती है और झिल्ली अपने सामान्य रेस्टिंग पोटेंशिअल, -70 mV के आसपास विध्रुवित हो जाती है।[3] हालांकि, अगर विध्रुवण काफी बड़ा है, तो आवक सोडियम धारा, जावक पोटेशियम धारा से अधिक हो जाती है और एक भगोड़ा स्थिति (धनात्मक प्रतिक्रिया) उत्पन्न होती है: जितना ज्यादा आवक धारा होगी उतना ही अधिक V m बढ़ जाता है, जो बदले में आवक धारा को और अधिक बढ़ा देता है।[4] एक पर्याप्त मजबूत विध्रुवण (V m में वृद्धि) वोल्टेज के प्रति संवेदनशील सोडियम चैनलों को खोलता है; सोडियम के प्रति बढ़ती पारगम्यता V m को सोडियम संतुलन वोल्टेज E Na≈ +55 mV के करीब ले जाती है। बदले में बढ़ता वोल्टेज और अधिक सोडियम चैनलों को खोलता है, जो V m को E Na की दिशा में और अधिक धकेलता है। यह धनात्मक प्रतिक्रिया तब तक जारी रहती है जब तक कि सोडियम चैनल पूरी तरह नहीं खुलते हैं और V m, ENa के नज़दीक नहीं हो जाता.[54] V m और सोडियम पारगम्यता में तेज वृद्धि ऐक्शन पोटेंशिअल के विकास चरण के अनुरूप होती है।[36]
इस तीव्र हालत के लिए महत्वपूर्ण थ्रेशहोल्ड वोल्टेज आमतौर पर -45 mV के आसपास होता है, लेकिन यह अक्षतंतु की हाल की गतिविधि पर निर्भर करता है। एक झिल्ली जिसने अभी-अभी एक ऐक्शन पोटेंशिअल फायर किया है वह तुरंत दूसरा फायर नहीं कर सकती, क्योंकि आयन चैनल अपनी सामान्य स्थिति में वापस नहीं आए होते हैं। वह अवधि जिसके दौरान कोई नया ऐक्शन पोटेंशिअल फायर नहीं किया जा सकता है उसे एब्सोल्यूट रिफ्रैक्टरी पीरिअड कहा जाता है।[55] लम्बे समय में, कुछ आयन चैनलों के पुनर्स्थापित हो जाने के बाद, अक्षतंतु को अन्य ऐक्शन पोटेंशिअल उत्पादन के लिए प्रेरित किया जा सकता है, लेकिन केवल एक बहुत मजबूत विध्रुवण के साथ, जैसे, -30 mV. वह अवधि जिसके दौरान ऐक्शन पोटेंशिअल को प्रेरित करना असामान्य रूप से कठिन होता है उसे रिलेटिव रेफ्रैक्टरी पीरिअड कहा जाता है।[55]
चरम और गिरावट चरण
विकास चरण की सकारात्मक प्रतिक्रिया धीमी हो जाती है और जब सोडियम आयन चैनल अधिकतम खुलते हैं तो वह रुक जाती है। ऐक्शन पोटेंशिअल के चरम पर, सोडियम पारगम्यता अधिकतम होती है और झिल्ली वोल्टेज V m, सोडियम संतुलन वोल्टेज E Na के लगभग बराबर होता है। हालांकि, वही वर्धित वोल्टेज जिसने शुरू में सोडियम चैनल को खोला था, वही उनके पोरों को बंद करते हुए उन्हें धीरे-धीरे बन्द कर देता है; सोडियम चैनल निष्क्रिय हो जाते हैं।[50] इससे सोडियम के लिए झिल्ली की पारगम्यता कम हो जाती है, जो झिल्ली वोल्टेज वापस नीचे कर देती है। उसी समय, वर्धित वोल्टेज, वोल्टेज के प्रति संवेदनशील पोटेशियम चैनल को खोलता है; झिल्ली की पोटेशियम पारगम्यता में वृद्धि V m को E K की ओर ले जाती है।[50] संयुक्त रूप से, सोडियम और पोटेशियम पारगम्यता में इन परिवर्तनों के कारण Vm तेज़ी से नीचे गिर जाता है और झिल्ली को पुनर्ध्रुवित करता है और ऐक्शन पोटेंशिअल के "पतन चरण" को उत्पन्न करता है।[56][56]
उच्च-ध्रुवीकरण के पश्चात
वर्धित वोल्टेज ने सामान्य से कई अधिक पोटेशियम चैनल खोल दिए और इनमें से कुछ तुरंत उस वक्त बंद नहीं हो गए जब झिल्ली अपने सामान्य विश्राम वोल्टेज में वापस आ गई। इसके अलावा, ऐक्शन पोटेंशिअल के दौरान, कैल्शियम आयनों के प्रवाह की प्रतिक्रिया में अन्य पोटेशियम चैनल खुल गए। झिल्ली की पोटेशियम पारगम्यता, क्षणिक रूप से असामान्य रूप से अधिक होती है, जो झिल्ली वोल्टेज V m को पोटेशियम संतुलन वोल्टेज E K के नज़दीक ले आती है। इसलिए, वहां एक अंडरशूट या उच्चध्रुवीकरण होता है, जिसे तकनीकी भाषा में आफ्टरहाइपरपोलराईज़ेशन कहा जाता है, जो तब तक चलता है जब तक कि झिल्ली की पोटेशियम पारगम्यता अपने सामान्य मूल्य पर नहीं आ जाती.[57]
दु:साध्य अवधि
प्रत्येक ऐक्शन पोटेंशिअल के बाद एक दु:साध्य अवधि होती है, जिसे एब्सोल्यूट रिफ्रैक्टरी पीरिअड, जिसके दौरान एक अन्य ऐक्शन पोटेंशिअल को प्रेरित करना असंभव होता है और रिलेटिव रेफ्रैक्टरी पीरिअड, जिसके दौरान एक सामान्य-से-मजबूत प्रेरक की आवश्यकता होती है में विभाजित किया जा सकता है।[55] ये दो दु:साध्य अवधियां, सोडियम और पोटेशियम चैनल अणुओं की स्थिति में परिवर्तन के कारण होती हैं। सोडियम चैनल, जब ऐक्शन पोटेंशिअल के बाद बंद होते हैं, तो वे एक "निष्क्रिय" अवस्था में प्रवेश करते हैं, जिसमें उन्हें झिल्ली पोटेंशिअल के होते हुए भी खोला नहीं जा सकता - इससे निरपेक्ष दु:साध्य अवधि का जन्म होता है। सोडियम चैनल की एक पर्याप्त संख्या के अपने विश्राम स्थिति में परिवर्तन के बाद भी, ऐसा अक्सर होता है कि पोटेशियम चैनलों का एक अंश खुला रहता है, जिससे झिल्ली पोटेंशिअल के लिए विध्रुवण मुश्किल होता है और इससे सापेक्ष दु:साध्य अवधि की उत्पत्ति होती है। क्योंकि पोटेशियम चैनलों का घनत्व और उपप्रकार, भिन्न प्रकार के न्यूरॉन्स के बीच भिन्न हो सकता है, सापेक्ष दु:साध्य अवधि उच्च रूप से अस्थिर होती है।
निरपेक्ष दु:साध्य अवधि, अक्षतन्तु के इर्द-गिर्द ऐक्शन पोटेंशिअल के दिशाहीन प्रसार के लिए काफी हद तक जिम्मेदार है।[58] किसी भी समय, सक्रिय रूप छेदित भाग के पीछे अक्षतंतु का पैच दुहसाध्य है, लेकिन सामने का पैच, हाल ही में सक्रिय नहीं किये जाने के कारण ऐक्शन पोटेंशिअल से विध्रुवण से प्रेरित होने में सक्षम है।
प्रसार
अक्षतंतु गिरिका पर जनित ऐक्शन पोटेंशिअल अक्षतंतु पर एक लहर के रूप में फैलता है।[59] एक ऐक्शन पोटेंशिअल के दौरान अक्षतंतु पर एक बिंदु पर अंदर की ओर बहती धाराएं अक्षतंतु पर फ़ैल जाती हैं और अपने झिल्ली के आसन्न वर्गों को विध्रुवित कर देती हैं। यदि पर्याप्त मजबूत है, तो यह विध्रुवण पड़ोसी झिल्ली पैच में एक समान ऐक्शन पोटेंशिअल प्रेरित करता है। इस बुनियादी तंत्र को 1937 में एलन लॉयड हौज्किन द्वारा प्रदर्शित किया गया था। तंत्रिका खंडो को कुचलने या ठंडा करने और इस प्रकार ऐक्शन पोटेंशिअल को ब्लॉक करने के बाद, उन्होंने दिखाया कि खंड के एक तरफ पहुंचने वाला ऐक्शन पोटेंशिअल दूसरी तरफ एक अन्य ऐक्शन पोटेंशिअल को उभार सकता था, बशर्ते कि अवरोधित खंड पर्याप्त रूप से छोटा हो। [60]
एक बार झिल्ली के एक पैच पर एक ऐक्शन पोटेंशिअल के होने पर, झिल्ली पैच को फिर से फायर करने के लिए ठीक होने की जरूरत होती है। आणविक स्तर पर, यह निरपेक्ष दुहसाध्य अवधि उस समय के अनुरूप होती है जो वोल्टेज-सक्रिय सोडियम चैनल को निष्क्रियता से ठीक होने में लगती है, यानी अपने बंद रूप में लौटने में.[61] न्यूरॉन्स में वोल्टेज-सक्रिय पोटेशियम चैनलों के कई प्रकार हैं, उनमें से कई तेजी से निष्क्रिय होते हैं (A-टाइप करेंट) और उनमें से कुछ धीरे-धीरे निष्क्रिय होते हैं या निष्क्रिय होते ही नहीं; यह परिवर्तनशीलता इस बात की गारंटी देती है कि पुनःध्रुवण के लिए वहां हमेशा करेंट का एक उपलब्ध स्रोत होगा, तब भी जब पूर्ववर्ती विध्रुवण की वजह से पोटेशियम चैनल निष्क्रिय हैं। दूसरी ओर, सभी न्यूरोनल वोल्टेज-सक्रिय सोडियम चैनल, मजबूत विध्रुवण के दौरान कई मिलीसेकंड के भीतर निष्क्रिय हो जाते हैं, इस प्रकार अगले विध्रुवण को असंभव बना देते हैं जब तक कि सोडियम चैनल का एक महत्वपूर्ण अंश अपनी बंद स्थिति में वापस नहीं लौट आता. हालांकि, यह फायरिंग की सीमा को सीमित करता है,[62] निरपेक्ष दुहसाध्य अवधि यह सुनिश्चित करती है कि ऐक्शन पोटेंशिअल एक अक्षतंतु से लगे हुए केवल एक ही दिशा में चले.[58] एक ऐक्शन पोटेंशिअल की वजह से अंदर प्रवाहित होने वाला करेंट, अक्षतंतु के आस-पास दोनों दिशाओं में फैलता है।[63] हालांकि, अक्षतंतु का केवल बिना फायर वाला भाग, एक ऐक्शन पोटेंशिअल के साथ प्रतिक्रिया कर सकता है; वह हिस्सा जिसने अभी-अभी फायर किया है वह तब तक निष्क्रिय होता है जब तक कि ऐक्शन पोटेंशिअल सुरक्षित रूप से सीमा से बाहर नहीं हो जाता और उस हिस्से को पुनः उत्तेजित नहीं करता. सामान्य ओर्थोड्रोमिक चालन में ऐक्शन पोटेंशिअल अक्षतंतु गिरिका से सिनेप्टिक नौब (एक्सनल टर्मिनी) की ओर प्रसारित होता है; विपरीत दिशा में प्रसार - जिसे एंटीड्रोमिक चालन के रूप में जाना जाता है - अत्यंत दुर्लभ है।[64] हालांकि, अगर एक प्रयोगशाला अक्षतंतु को इसके बीच में प्रेरित किया जाता है तो अक्षतंतु के दोनों भाग "फ्रेश" होते हैं, अर्थात बिना फायर के; तब दो ऐक्शन पोटेंशिअल उत्पन्न होते हैं, जिसमें से एक अक्षतंतु गिरिका की ओर यात्रा करता है और दूसरा सिनेप्टिक नौब की दिशा में यात्रा करता है।

मेलिन और नाटकीय चालन
तंत्रिका तंत्र में विद्युत् संकेतों के तीव्र और असरकारी ट्रांन्सडक्सन की विकासवादी जरूरत ने न्यूरोनल अक्षतन्तु के आसपास मेलिन शीथ की उपस्थिति को परिणामित किया। मेलिन एक बहु लामेलर झिल्ली है जो अक्षतन्तु को, नोड्स ऑफ़ रैन्विअर कहे जाने वाले अंतराल द्वारा अलग क्षेत्रों में लपेटती है, वह विशेष कोशिकाओं, श्वान कोशिकाओं द्वारा उत्पन्न होती है, विशेष रूप से परिधीय तंत्रिका तंत्र में और विशेष रूप से केन्द्रीय तंत्रिका तंत्र में ओलिगोडेन्ड्रोसाईट द्वारा. मेलिन शीथ, इंटर-नोड अंतराल में झिल्ली क्षमता को कम कर देता है और झिल्ली प्रतिरोध को बढ़ा देता है और इस प्रकार एक नोड से दूसरे नोड में ऐक्शन पोटेंशिअल के एक तेज़, नाटकीय गतिविधि की अनुमति देता है।[65][66][67] मेलिन क्रिया मुख्य रूप से रीढ़वाले प्राणियों में पाई जाती है, लेकिन बिना रीढ़ वाले प्राणियों में से कुछ में एक अनुरूप प्रणाली पाई गई है, जैसे चिंराट प्रजातियों में से कुछ में.[68]. रीढ़ वाले प्राणी में सभी न्यूरॉन्स मेलिनकृत नहीं होते; उदाहरण के लिए, स्वायत्त (वनस्पति) तंत्रिका तंत्र वाले न्यूरॉन्स के अक्षतन्तु, सामान्य रूप में मेलिनकृत नहीं होते.
मेलिन, आयनों को मेलिनकृत क्षेत्रों में अक्षतंतु से जाने या आने से बचाता है। एक सामान्य नियम के रूप में, मेलिन क्रिया ऐक्शन पोटेंशिअल के चालन गति को बढ़ा देता है और उन्हें और अधिक ऊर्जा कुशल बनाता है। चाहे ऊबड़-खाबड़ हो या ना हो, एक ऐक्शन पोटेंशिअल की औसत चालन गति 1 m/s से 100 m/s के ऊपर तक होती है और सामान्य रूप में अक्षतन्तु व्यास से अधिक होती है।[69]
ऐक्शन पोटेंशिअल झिल्ली के माध्यम से अक्षतंतु के मेलिनकृत क्षेत्रों में प्रसार नहीं कर सकते हैं। हालांकि, करेंट को साइटोप्लाज्म द्वारा ले जाया जाता है, जो अगले 1 या 2 नोड ऑफ़ रैनविअर को विध्रुवित करने के लिए पर्याप्त हैं। इसके बजाय, एक ऐक्शन पोटेंशिअल से एक नोड ऑफ़ रेनविअर पर आयनिक करेंट एक दूसरे ऐक्शन पोटेंशिअल को अगले नोड पर भड़काती है; एक नोड से दूसरे नोड पर ऐक्शन पोटेंशिअल की यह स्पष्ट कूद, नाटकीय चालन कहलाती है। हालांकि नाटकीय चालन के तंत्र को राल्फ लिली द्वारा 1925 में सुझाया गया था,[70] नाटकीय चालन का पहला प्रयोगात्मक सबूत तसाकी इचिजी[71] और ताईजी टेकेउची[72] ने प्रस्तुत किया और एंड्रयू हक्सले और रॉबर्ट स्टेमफ्ली ने.[73] विरोधाभास स्वरूप, बिना मेलिनकृत अक्षतन्तु में, ऐक्शन पोटेंशिअल ठीक बगल की झिल्ली में एक अन्य को भड़काता है और लगातार एक लहर की तरह अक्षतंतु में नीचे जाता है।

मेलिन में दो महत्वपूर्ण लाभ है: तेज़ चालन गति और ऊर्जा क्षमता. न्यूनतम व्यास से बड़े अक्षतन्तु के लिए (मोटे तौर पर 1 माइक्रोमीटर), मेलिनक्रिया, ऐक्शन पोटेंशिअल के चालन वेग को आम तौर पर दस गुना बढ़ा देती है।[76] इसके विपरीत, एक दिये गए चालन वेग के लिए, मेलिनकृत फाइबर अपने बिना मेलिनकृत समकक्षों की तुलना में छोटे होते हैं। उदाहरण के लिए, ऐक्शन पोटेंशिअल एक मेलिनकृत फ्रोग अक्षतंतु में और एक बिना मेलिनकृत विशाल स्क्विड अक्षतंतु में मोटे तौर पर उसी गति (25 m/s) से चलते हैं, लेकिन फ्रोग अक्षतंतु का लगभग 30 गुना छोटा व्यास होता है और 1000 गुना छोटा पार-अनुभागीय क्षेत्र होता है। इसके अलावा, चूंकि आयनिक करेंट, नोड्स ऑफ़ रेनविअर में सीमित होती हैं, बहुत कम आयनों का "रिसाव" झिल्ली के पार होता है, जिससे चयापचय ऊर्जा की बचत होती है। यह बचत एक महत्वपूर्ण चयनात्मक लाभ है, क्योंकि मानव तंत्रिका तंत्र शरीर की चयापचय ऊर्जा का 20% का उपयोग करता है।[76]
अक्षतन्तु के मेलिनकृत सेगमेंट की लंबाई, नाटकीय प्रवाहकत्त्व की सफलता के लिए महत्वपूर्ण है। चालन की गति को अधिकतम करने के लिए उन्हें जितना संभव हो सके लंबा होना चाहिए, लेकिन इतना लम्बा नहीं होना चाहिए कि आने वाला संकेत इतना कमज़ोर हो कि वह अगले नोड ऑफ़ रेनविअर पर एक ऐक्शन पोटेंशिअल को उत्पन्न करने में असमर्थ हो। प्रकृति में, मेलिनकृत क्षेत्र आम तौर पर निष्क्रिय रूप से प्रसारित संकेत के लिए यह काफी होता है कम से कम दो नोड्स के लिए यात्रा करते समय और पर्याप्त आयाम बनाए रखता है ताकि दूसरे या तीसरे नोड पर एक ऐक्शन पोटेंशिअल को फायर किया जा सके। इस प्रकार, नाटकीय प्रवाहकत्त्व का सुरक्षा कारक उच्च है, जो चोट के मामले में प्रसारण को नोड को बायपास करने की अनुमति देता है। हालांकि, ऐक्शन पोटेंशिअल, कुछ स्थानों पर समय से पहले ही समाप्त हो सकता है जहां सुरक्षा कारक कम है, यहां तक कि बिना मेलिनकृत न्यूरॉन्स में भी; एक सामान्य उदाहरण है, अक्षतंतु का विभाजन बिंदु जहां यह दो अक्षतंतु में विभाजित होता है।[77]
कुछ बीमारियां मेलिन को ख़राब कर देती हैं और नाटकीय प्रवाहकत्त्व को क्षीण कर देती हैं और ऐक्शन पोटेंशिअल के प्रवाह वेग को कम कर देती हैं।[78] इसका सबसे अच्छा ज्ञात रूप है एकाधिक काठिन्य, जिसमें मेलिन का टूटन समन्वित गतिविधियों को बिगाड़ता है।[79]
केबल सिद्धांत

एक अक्षतंतु के भीतर धाराओं का प्रवाह, केबल सिद्धांत द्वारा मात्रात्मक रूप से वर्णित किया जा सकता है[80] और उसकी व्याख्या द्वारा, जैसे पूरक मॉडल.[81] केबल सिद्धांत को ट्रान्साटलांटिक टेलीग्राफ केबल को स्वरूपित करने के लिए 1855 में लोर्ड केल्विन द्वारा विकसित किया गया था[82] और 1946 में होज्किन और रुष्टोन द्वारा न्यूरॉन्स के लिए प्रासंगिक दिखाया गया।[83] साधारण केबल सिद्धांत में, न्यूरॉन को विद्युत् रूप से निष्क्रिय माना जाता है, बिलकुल बेलनाकार संचरण केबल, जिसे एक आंशिक अंतर समीकरण द्वारा वर्णित किया जा सकता है।[80]
जहां V(x,t), t समय और x स्थिति में एक न्यूरॉन की लंबाई के साथ झिल्ली में व्याप्त वोल्टेज है और जहां λ और τ विशेषता लंबाई और समय है जिस पर प्रेरक के लिए प्रतिक्रिया में वोल्टेज क्षय होता है। उपरोक्त सर्किट आरेख के सन्दर्भ में, इन पैमानों को प्रति यूनिट प्रतिरोध और संधारित्र से निर्धारित किया जा सकता है।[84]
इन समय और लंबाई को बिना मेलिन फाइबर में न्यूरॉन के व्यास पर चालन वेग की निर्भरता समझने के लिए इस्तेमाल किया जा सकता है। उदाहरण के लिए, समय पैमाना τ, झिल्ली प्रतिरोध r m और धारिता c m , दोनों के साथ बढ़ता है। जैसे-जैसे धारिता बढ़ती है, तो एक दिये गए ट्रांसमेम्ब्रेन वोल्टेज को उत्पन्न करने के लिए और अधिक चार्ज को स्थानांतरित करने की आवश्यकता होती है, (समीकरण Q =CV द्वारा)। इसी तरह के तरीके में, यदि प्रतिरोध प्रति यूनिट आंतरिक लंबाई r i , किसी अन्य की तुलना में एक अक्षतंतु से कम है, (क्योंकि पूर्व की त्रिज्या लम्बी है), स्थानिक क्षय लंबाई λ लम्बी हो जाती है और एक ऐक्शन पोटेंशिअल का प्रवाह वेग बढ़ना चाहिए। अगर ट्रांसमेम्ब्रेन प्रतिरोध r m में वृद्धि होती है, तो वह सम्पूर्ण झिल्ली में औसत "रिसाव" को कम कर देता है, वैसे ही λ को लम्बा कर देता है, जिससे प्रवाह वेग बढ़ जाता है।
समाप्ति
रासायनिक सिनेप्सेस
सामान्य रूप से, जो ऐक्शन पोटेंशिअल सिनेप्टिक नौब तक पहुंचते हैं वे एक तंत्रिकासंचारक को सिनेप्टिक क्लेफ्ट में स्रावित होने को प्रेरित करते हैं।[85] न्यूरोट्रांसमीटर छोटे अणु हैं जो पोस्टसिनेप्टिक कोशिका में आयन चैनल को खोल सकते हैं, अधिकांश अक्षतंतु में उनके सभी टर्मिनी पर समान तंत्रिकासंचारक होता है। ऐक्शन पोटेंशिअल का आगमन वोल्टेज-संवेदनशील कैल्शियम चैनलों को प्रीसिनेप्टिक मेम्ब्रेन में, कैल्शियम के आने से तंत्रिकासंचारक वेसिकल्स से भर जाता है जो कोशिका की सतह पर विस्थापित हो जाता है और अपनी सामग्री सिनेप्टिक क्लेफ्ट में जरी करता है।[86] इस जटिल प्रक्रिया को न्यूरोटोक्सिन टेटानोस्पाज्मिन और बोटुलिनम टोक्सिन द्वारा अवरोधन किया जाता है जो क्रमश: टेटनस और बोटुलिज़्म के लिए जिम्मेदार हैं।[87]

विद्युत सिनेप्सेस
कुछ सिनेप्सेस, तंत्रिकासंचारक "बिचौलिया" को हटा देते हैं और प्रीसिनेप्टिक और पोस्टसिनेप्टिक कोशिकाओं को जोड़ देते हैं।[88] जब एक ऐक्शन पोटेंशिअल ऐसे सिनेप्सेस तक पहुंचता है, आयनिक धाराएं जो प्रीसिनेप्टिक सेल में बहती हैं वे बाधा झिल्लियों के माध्यम से पार कर सकते हैं और कोनेक्सिन कहे जाने वाले पोरों से पोस्टसिनेप्टिक कक्ष में प्रवेश कर सकती हैं।[89] इस प्रकार, प्रीसिनेप्टिक ऐक्शन पोटेंशिअल की क्षमता का आयनिक धाराएं, सीधे पोस्टसिनेप्टिक सेल को प्रोत्साहित कर सकती हैं। विद्युत सिनेप्सेस तेज़ प्रसारण की अनुमति देते हैं क्योंकि उन्हें सिनेप्टिक क्लेफ्ट में तंत्रिकासंचारक के धीमे प्रसार की आवश्यकता नहीं होती है। इसलिए, विद्युत सिनेप्सेस का तब उपयोग किया जाता है जब तेज प्रतिक्रिया और समय का समन्वय महत्वपूर्ण हो, जैसा कि इस्केप रिफ्लेक्स में होता है, रीढ़वाले प्राणी की रेटिना और हृदय में.
तंत्रिकापेशीय जोड़
रासायनिक सिनेप्स का एक विशेष मामला है तंत्रिकापेशीय जोड़, जिसमें एक मोटर न्यूरोन का अक्षतंतु पेशी फाइबर पर समाप्त होता है।[90] ऐसे मामलों में, जारी तंत्रिकासंचारक एसीटीकोलीन है, जो एसीटी कोलीन रिसेप्टर से आबद्ध होता है, पेशी फाइबर का मेम्ब्रेन में एक अभिन्न मेम्ब्रेन प्रोटीन है (सरकोलेम्मा)। [91] हालांकि, एसीटीकोलीन बंधा नहीं रहता है बल्कि अलग हो जाता है और सिनेप्स में स्थित इन्जाइम, एसीटीकोलीनस्टेरेज़ द्वारा हाइड्रोलाइज होता है। यह एंजाइम जल्दी से मांसपेशियों की उत्तेजना को कम कर देता है, जो मांसपेशियों में संकुचन के स्तर और समय को नाजुक रूप से विनियमित करने की अनुमति देता है। इस नियंत्रण को रोकने के लिए कुछ ज़हर एसीटीकोलीनस्टेरेज़ को निष्क्रिय कर देते हैं, जैसे नर्व एजेंट सरीन और टबून,[92] और कीटनाशक डायज़ीनोन और मेलाथियान.[93]
अन्य कोशिका प्रकार
कार्डियक ऐक्शन पोटेंशिअल

कार्डियक ऐक्शन पोटेंशिअल, एक न्यूरोनल ऐक्शन पोटेंशिअल से एक वर्धित प्लेटू के मामले में भिन्न होता है, जिसमें मेम्ब्रेन को, पोटेशियम धारा द्वारा पुनः विध्रुवण से पहले कुछ सौ मिलीसेकंड के लिए उच्च वोल्टेज पर रखा जाता है।[94] यह प्लेटू, धीमे कैल्शियम चैनल की वजह से होता है जो सोडियम चैनलों के निष्क्रिय होने के बाद भी संतुलन पोटेंशिअल धारण किया जाता है।
कार्डियक ऐक्शन पोटेंशिअल हृदय संकुचन के समन्वय में एक महत्वपूर्ण भूमिका निभाता है।[94] सीनोएट्रिअल नोड की हृदय कोशिकाएं पेसमेकर पोटेंशिअल प्रदान करती हैं जो हृदय को समक्रमिक करता है। उन कोशिका का ऐक्शन पोटेंशिअल, एट्रियोवेंट्रिक्युलर नोड (AV नोड) के माध्यम से फैलता है, जो एट्रियल और वेट्रिकल्स के बीच सामान्य प्रवाह पथ है। ए वी नोड से एक्शन पोटेंशिअल, हिस के माध्यम से यात्रा करता है और फिर पुर्किन्जे फाइबर जाता है।[note 2] इसके विपरीत, विसंगतियां कार्डियक ऐक्शन पोटेंशिअल में अतालता है, एक जन्मजात विकृतियों के कारण परिवर्तन कर सकते हैं विशेष रूप से मानव निदान में.[94] कई अतालता-विरोधी दवा कार्डिएक ऐक्शन पोटेंशिअल पर काम करती है, जैसे क्विनडाइन, लिडोकेन, बीटा ब्लोकर्स और वेरापामिल.[95]
पेशीय ऐक्शन पोटेंशिअल
एक सामान्य कंकाल की मांसपेशी कोशिका में ऐक्शन पोटेंशिअल, न्यूरॉन्स में होने वाले ऐक्शन पोटेंशिअल के समान है।[96] ऐक्शन पोटेंशिअल, कोशिका झिल्ली (सरकोलेम्मा) के विध्रुवण से फलित होते हैं, जो वोल्टेज-संवेदनशील सोडियम चैनल को खोलता है; ये निष्क्रिय हो जाते हैं और झिल्ली, पोटेशियम आयनों के जावक धरा से पुनः विध्रुववित होती है। ऐक्शन पोटेंशिअल से पहले रेस्टिंग पोटेंशिअल आमतौर पर -90mV है, जो विशिष्ट न्यूरॉन्स की तुलना में कुछ अधिक ऋणात्मक है। मांसपेशी ऐक्शन पोटेंशिअल लगभग 2-4 ms रहती है, निरपेक्ष अवधि लगभग 1-3 ms होती है और मांसपेशियों के साथ चालन वेग लगभग 5 m/s होता है। ऐक्शन पोटेंशिअल, कैल्शियम आयनों को जारी करता है जो ट्रोपोमायोसिन को मुक्त करता है और मांसपेशियों के संकुचन को अनुमति देता है। मांसपेशियों का ऐक्शन पोटेंशिअल, तंत्रिकापेशीय जोड़ पर प्रीसिनेप्टिक न्यूरोनल ऐक्शन पोटेंशिअल के पहुंचने से प्रेरित होता है, जो न्यूरोटोक्सिन का एक आम लक्ष्य है।[92]
प्लांट ऐक्शन पोटेंशिअल
पौधों और फंगल कोशिकाओं[97] में भी विद्युतीय रूप से उत्तेजना होती है। पशु ऐक्शन पोटेंशिअल का मौलिक अंतर है, कि पौधे की कोशिकाओं में विध्रुवण, धनात्मक सोडियम आयनों से पूरा नहीं होता बल्कि ऋणात्मक क्लोराइड आयनों द्वारा होता है।[98][99][100] ऐक्शन पोटेंशिअल जो पशु और पौधों के ऐक्शन पोटेंशिअल में आम है वह है धनात्मक पोटेशियम आयनों का एक साथ जारी होना, इसलिए नमक की आसमाटिक हानि (केसीआई), जबकि पशु ऐक्शन पोटेंशिअल ओस्मोटिक आधार पर तटस्थ है, जब आवक सोडियम और बाहर जाने वाले पोटेशियम की बराबर राशि एक दूसरे को ओस्मोटिक आधार पर रद्द करती है। पौधों की कोशिकाओं में विद्युतीय और आसमाटिक संबंध[101] आम रूप से एक छोटी उपलब्धि आसमाटिक का संकेत देते हैं, पौधों के एक कोशिकीय पूर्वजों में आम लवणता की स्थिति बदलती है जबकि तीव्र संकेत संचारण की मौजूदा क्रिया को पशुओं के तहत देखा जाता है, एक स्थिर मेटाजोआ पर्यावरण में.[102] यह माना जाना चाहिए कि कोशिकाओं को ग्रहण किया जाना चाहिए, कुछ उदाहरण संवहनी पौधे मिमोसा पुडिका (छुईमुई) में ऐक्शन पोटेंशिअल की क्रिया, उत्तेजनीय मेटाजोआ कोशिका से स्वतंत्र रूप से उत्पन्न होती है।
वर्गीकरण वितरण और विकासवादी लाभ
ऐक्शन पोटेंशिअल, सम्पूर्ण बहुकोशिकीय जीवों में पाए जाते हैं, जिसमें शामिल हैं पौधे, गैर-रीढ़धारी जैसे कीट और रीढ़धारी जैसे सर्प और स्तनपायी.[103] स्पंज, बहु-कोशिकीय युकेरिओट का मुख्य समुदाय लगते हैं, जो ऐक्शन पोटेंशिअल संचारित नहीं करते, हालांकि कुछ अध्ययनों ने सुझाव दिया है कि इन जीवों में विद्युतीय संकेत के कुछ रूप हैं।[104] रेस्टिंग पोटेंशिअल, साथ ही साथ ऐक्शन पोटेंशिअल का आकार और अवधि में विकास के साथ बहुत भिन्नता नहीं आई है, हालांकि चालन वेग, मेलिनक्रिया और अक्षतंतु व्यास के साथ नाटकीय रूप से भिन्न हुआ है।
| [105] | |||||
| पशु | कोशिका प्रकार | रेस्टिंग पोटेंशिअल (mV) | एपी वृद्धि (mV) | एपी अवधि (ms) | प्रवाह गति (m/s) |
|---|---|---|---|---|---|
| स्क्विड (लोलिगो) | विशाल अक्षतंतु | -60 | 120 | 0.75 | 35 |
| केंचुआ (लुम्ब्रिकस) | माध्यम विशाल फाइबर | -70 | 100 | 1.0 | 30 |
| तिलचट्टा (पेरीप्लानेटा) | विशाल फाइबर | -70 | 80-104 | 0.4 | 10 |
| मेंढक (राना) | सिएटिक तंत्रिका अक्षतंतु | -60 से -80 | 110-130 | 1.0 | 7-30 |
| बिल्ली (फेलिस) | स्पाइनल मोटर न्यूरॉन | -55 से -80 | 80-110 | 1-1.5 | 30-120 |
सम्पूर्ण विकास के दौरान इसके संरक्षण को देखते हुए ऐक्शन पोटेंशिअल विकासवादी लाभ प्रदान करने लगता है। ऐक्शन पोटेंशिअल का एक काम है तेजी से, लंबे समय से जीव के भीतर संकेतन; चालन वेग, 110 m/s से अधिक हो सकता है, जो ध्वनि की गति का एक-तिहाई है। कोई भौतिक वस्तु पूरे शरीर भर में उतनी तेज़ी से संकेत नहीं दे सकती; तुलना के लिए, एक हार्मोन अणु, मोटे तौर पर बड़े धमनियों में 8 m/s की गति से चलता है। इस क्रिया का हिस्सा है हृदय के संकुचन जैसे यांत्रिक घटनाएं, के तंग समन्वय है। एक दूसरी क्रिया गणना है जो इसकी पीढ़ी के साथ जुड़े है। ऑल-और-नन संकेत होने के नाते सभी संचरण नष्ट नहीं हो जाते, क्षय कि कोई भी संकेत, ऐक्शन पोटेंशिअल के लिए डिजिटल इलेक्ट्रॉनिक्स के समान फायदे हैं। अक्षतंतु गिरिका पर इसके विभिन्न डेन्ड्रिटिक संकेतों का एकीकरण और ऐक्शन पोटेंशिअल की एक जटिल ट्रेन बनाने के लिए इसकी थ्रेशहोल्डिंग, परिकलन का एक अन्य रूप है, जिसका उपयोग कृत्रिम तंत्रिका नेटवर्क में जैविक रूप से सेन्ट्रल पैटर्न जनरेटर के लिए किया जाता है।
प्रयोगात्मक विधियां

ऐक्शन पोटेंशिअल के अध्ययन के लिए नई प्रयोगात्मक विधियों के विकास की आवश्यकता है। 1955 के पहले के प्रारंभिक कार्यों ने तीन लक्ष्यों पर ध्यान केन्द्रित किया: एकल न्यूरॉन्स या अक्षतंतु से संकेतों को अलग करना, तेज़, संवेदनशील इलेक्ट्रॉनिक्स का विकास करना और इलेक्ट्रोड का इतना संकुचन ताकि एक एकल कोशिका के अंदर वोल्टेज को रिकॉर्ड किया जा सके।
पहली समस्या को स्क्विड जीनस लोलिगो के न्यूरॉन्स अक्षतंतु के अध्ययन से हल किया गया था।[106] इन अक्षतंतु का व्यास काफी बड़ा होता है (लगभग 1 मिमी, या एक ठेठ न्यूरॉन से 100 गुना बड़ा) और उन्हें नग्न आंखों से देखा जा सकता है, उन्हें निकालने के लिए बनाने के लिए आसान है।[49][107] हालांकि, लोलिगो अक्षतंतु, सभी उत्तेजनीय कोशिकाओं के प्रतिनिधि नहीं हैं और ऐक्शन पोटेंशिअल की कई अन्य प्रणालियों का अध्ययन किया गया है।
दूसरी समस्या को क्लैंप वोल्टेज के महत्वपूर्ण विकास के साथ संबोधित किया गया था,[108] जिसने ऐक्शन पोटेंशिअल में अलग से अंतर्निहित आयनिक करेंट के अध्ययन की अनुमति दी और इलेक्ट्रॉनिक शोर के एक मुख्य स्रोत को समाप्त किया, करेंट I C जो संधारित्र C के साथ जुडा है।[109] चूंकि धरा ट्रांसमेम्ब्रेन वोल्टेज Vm के बदलाव के C समय दर के समान होती है, समाधान एक ऐसा सर्किट डिजाइन करना था जो V m को स्थिर रखे (बदलाव का शून्य दर), चाहे झिल्ली में कोई भी धारा बह रही हो। इस प्रकार, V m को स्थिर रखने के लिए आवश्यक धारा झिल्ली के माध्यम से बहते करेंट का मूल्य निर्धारित रखने के लिए सीधा प्रतिबिंब है। अन्य इलेक्ट्रॉनिक अग्रिम उच्च वोल्टेज इनपुट के साथ शामिल है उपयोग के उच्च प्रतिबाधा वाले इलेक्ट्रॉनिक्स और फैराडे केज, इसलिए माप वाले वोल्टेज को खुद मापन प्रभावित नहीं करता.[110]
तीसरी समस्या है, एक छोटे से इलेक्ट्रोड को प्राप्त करना जो इतना छोटा हो जो वोल्टेज को रिकॉर्ड कर सके, एक एकल अक्षतंतु में बिना उसे परेशान किये हुए, इसे 1949 में ग्लास माइक्रोपेप्टाइड इलेक्ट्रोड के आविष्कार के साथ सुलझाया गया था,[111] जो अन्य शोधकर्ताओं द्वारा जल्दी अपना लिया गया।[112][113] इस विधि के शोधन के रूप में ठीक करने में सक्षम निर्माण करने के लिए सुझाव है कि इलेक्ट्रोड के टिप जो 100 Å (10 nm) हैं, जो उच्च प्रतिबाधा इनपुट देते हैं उनका प्रयोग किया जाना चाहिए। [114] ऐक्शन पोटेंशिअल को छोटे इलेक्ट्रोड धातु के साथ रिकॉर्ड किया जा सकता है जिसे न्यूरॉन के बस बगल में रखा जाता है। वोल्टेज के साथ न्यूरोचिप युक्त EOSFET या रंजक के साथ ऑप्टिकल रूप से जो Ca2+ के साथ संवेदनशील हैं।[115]

जबकि ग्लास माइक्रोपिपेट इलेक्ट्रोड आयन चैनलों के माध्यम से कई धाराओं को मापने के लिए राशि से गुज़रता है, चैनल एक एकल आयन के विद्युत गुणों का अध्ययन बर्ट सक्मन और इरविन नेहर द्वारा पैच क्लैंप विकास के लिए 1970 में किया गया। इसके लिए उन्हें 1991 में फिजियोलॉजी या चिकित्सा में नोबेल पुरस्कार से सम्मानित किया गया।[116] पैच-क्लेम्पिंग ने पुष्टि की कि आयनिक चैनल में असतात प्रवाहकत्त्व होता है जैसे खुलना, बंद होना और निष्क्रिय.
ऑप्टिकल इमेजिंग प्रौद्योगिकी हाल के वर्षों में विकसित की गई है ताकि ऐक्शन पोटेंशिअल को मापा जा सके, चाहे अल्ट्रा स्पेशल रेजोल्यूशन द्वारा या समकालिक बहुसाईट रिकॉर्डिंग के माध्यम से. वोल्टेज के प्रति संवेदनशील रंजक के उपयोग से ऐक्शन पोटेंशिअल को ऑप्टिकली किया गया है, जिसे ऐसा कार्डियोमायोसाईट मेम्ब्रेन छोटे पैच से दर्ज होता है।[117]
न्यूरोटोक्सिन

कई न्यूरोटोक्सिन, प्राकृतिक और सिंथेटिक, दोनों को ऐक्शन पोटेंशिअल को रोकने के लिए डिजाइन किया गया है। पुफेरफिश से टेट्रोडोटोक्सिन और सेक्सीटोक्सिन से गोनीऔलाक्स (रेड टाइड के लिए जिम्मेदार डिनोफ्लैजलेट) ऐक्शन पोटेंशिअल को ब्लॉक करते हैं,[118], इसी प्रकार काले अफ्रिकन सर्प से ड्रेन्ड्रोटोक्सिन वोल्टेज के प्रति संवेदनशील पोटेशियम चैनल को रोकता है। आयन चैनलों के इस तरह के अवरोधक, एक महत्वपूर्ण अनुसंधान कार्य करते हैं, पर चैनलों द्वारा करने के लिए वैज्ञानिकों को अनुमति देते हैं से विशिष्ट योगदान है, इस प्रकार वे अन्य चैनलों को अलग कर सकते हैं और आयन चैनलों की सफ़ाई को उनके संकेन्द्रण क्रिया द्वारा या एफिनिटी क्रोमैटोग्राफी द्वारा भी किया जा सकता है। हालांकि, इस तरह के अवरोधक प्रभावी न्यूरोटोक्सिन भी बनाते हैं और रासायनिक हथियार के रूप में उपयोग किया गया है। कीड़ों की आयन चैनलों के उद्देश्य से किया गया न्यूरोटोक्सिन प्रभावी कीटनाशक, रहा है, एक उदाहरण है सिंथेटिक पर्मेथ्रिन ऐक्शन पोटेंशिअल में शामिल सोडियम चैनलों को सक्रिय कर देता है। कीड़ों के आयन चैनल पर्याप्त उनके मानव समकक्षों से अलग हैं कि मानव में कुछ दुष्प्रभाव होते हैं। कई अन्य न्यूरोटोक्सिन ऐक्शन पोटेंशिअल के संचरण के साथ सिनेप्सेस, पर हस्तक्षेप करते हैं, विशेष रूप से न्यूरोमस्कुलर जंक्शन पर.
इतिहास

जानवरों की तंत्रिका प्रणाली में विद्युत की भूमिका को पहली बार विच्छेदित मेंढक में लुइगी गलवानी द्वारा पहचाना गया था, जिन्होंने इसका अध्ययन 1791-1797 तक किया।[119] गलवानी के परिणाम ने अलेसांद्रो वोल्टा को वोल्टिक पाइल विकसित करने के लिए प्रेरित किया - सबसे पहली ज्ञात बिजली बैटरी -जिसके साथ उन्होंने पशु विद्युत् का अध्ययन किया (जैसे विद्युत् ईल) डाइरेक्ट करेंट वोल्टेज के प्रयोग की भौतिक प्रतिक्रियाओं को। [120]
19वीं सदी के वैज्ञानिकों ने विद्युत संकेतों के प्रसार का तंत्रिका में अध्ययन किया (यानी न्यूरॉन के बंडलों में) और प्रदर्शन किया कि तंत्रिका ऊतक के ऊपर बनाया गया था कोशिका बजाय जुड़े नेटवर्क का एक की नलियों में (एक जालिका .[121] कार्लो मटयूसी ने गलवानी के अध्ययन को आगे बढ़ाया और प्रदर्शन किया कि कोशिका झिल्ली उन्हें भर में एक वोल्टेज की थी और वह डाइरेक्ट करेंट का उत्पादन कर सकती है। मटयूसी के कार्यों ने जर्मन फिसियोलोजिस्ट एमिल डु बोइस-रेमंड को प्रेरित किया जिन्होंने ऐक्शन पोटेंशिअल की खोज की। ऐक्शन पोटेंशिअल का प्रवाह वेग को पहली बार बोइस-रेमंड के मित्र हरमन वॉन हेल्मोत्ज़ ने 1850 में मापा. यह स्थापित करने के लिए कि ऊतक तंत्रिका कोशिकाओं से बना है, स्पेनिश चिकित्सक सैंटियागो रेमोन कजल और उनके छात्रों ने एक दाग का इस्तेमाल किया जिसे न्यूरॉन्स के विभिन्न आकारों को दिखाने के लिए कैमिलो गोल्गी द्वारा विकसित किया गया था, जिसे उन्होंने परिश्रम के साथ दर्शाया. अपनी खोज के लिए, गोल्गी और रेमोन वाई कजल को 1906 में फिजियोलॉजी का नोबेल पुरस्कार प्रदान किया गया।[122] उनके काम ने 19वीं सदी के न्यूरोअनाटोमी के एक लम्बे विवाद को हल कर दिया; गोल्गी ने खुद तंत्रिका प्रणाली के नेटवर्क मॉडल के लिए तर्क दिया था।

20वीं सदी, इलेक्ट्रोफिजियोलॉजी के लिए एक स्वर्ण युग थी। 1902 में और फिर 1912 में, जूलियस बर्नस्टेन ने परिकल्पना को विकसित किया कि ऐक्शन पोटेंशिअल, आयनों के लिए अक्षतंतु की पारगम्यता के परिवर्तन के चलते फलित होता है।[28] बर्नस्टेन की परिकल्पना की पुष्टि केन कोल और हावर्ड कर्टिस द्वारा की गई जिन्होंने दिखाया कि एक ऐक्शन पोटेंशिअल के दौरान झिल्ली प्रवाहकत्त्व बढ़ जाती है।[123] 1907 में, लुई लापिकु ने सुझाव दिया कि ऐक्शन पोटेंशिअल जिसे एक सीमा के रूप में उत्पन्न किया गया था वह क्रॉस था[124], जिसे बाद में आयनिक चालन के डाइनेमिक प्रणाली के एक उत्पाद के रूप में दिखाया गया। 1949 में, एलन होज्किन और बर्नार्ड काट्ज़ ने बर्नस्टेन की परिकल्पना को आगे सुधारा और यह माना कि भिन्न आयन में अक्षीय झिल्ली में भिन्न पारगम्यता होती है; विशेष रूप से उन्होंने ऐक्शन पोटेंशिअल में सोडियम पारगम्यता के महत्व का प्रदर्शन किया।[33] यह अनुसंधान होज्किन, काट्ज़ और एंड्रयू हक्सले के 1952 के पांच प्रपत्रों में फलित हुआ, जिसमें उन्होंने वोल्टेज क्लैम्प तकनीक का उपयोग किया और पोटेशियम और सोडियम के लिए अक्षीय मेम्ब्रेन की पारगम्यता को दर्शाया, जहां से उन्होंने ऐक्शन पोटेंशिअल को मात्रात्मक रूप से फिर से संगठित किया।[49] होज्किन और हक्सले ने अपने गणितीय मॉडल के गुणों को असतत आयन चैनल के साथ सहसंबद्ध किया जो कई स्थितियों में मौजूद रहता था, जिसमें शामिल था "खुला", "बंद" और "निष्क्रिय". उनकी परिकल्पनाओं की पुष्टि 1970 के दशक के मध्य और 1980 के दशक में इरविन नेहर और बर्ट साक्मन ने की, जिन्होंने पैच क्लेम्पिंग तकनीक का विकास व्यक्तिगत एकल प्रवाह चैनलों की जांच के लिए किया।[125] 21वीं सदी में, शोधकर्ताओं ने प्रवाह की इन स्थितियों के संरचनात्मक आधार के लिए खोज शुरू की, आयन प्रजातियों के लिए उनकी चयनात्मकता,[126] एटम-रिजोल्यूशन क्रिस्टल संरचना[17] के माध्यम से प्रतिदीप्ति दूरी मापन[127] और क्रायो-इलेक्ट्रॉन माइक्रोस्कोपी अध्ययन करता है।[128]
जूलियस बर्नस्टेन ने ही पहली बार रेस्टिंग पोटेंशिअल के लिए नार्न्स्त समीकरण पेश किया था, यह 1943 में डेविड ई गोल्डमन द्वारा गोल्डमन समीकरण के रूप में सामान्यीकृत किया गया।[30] सोडियम पोटेशियम-पंप 1957 में पहचाना गया[129] और उसके गुण को धीरे-धीरे विस्तारित किया गया,[23][24][130] जो एक्स-रे क्रिस्टलोग्राफी द्वारा परमाणु संकल्प संरचना के निर्धारण में फलित हुआ।[131] संबंधित आयनिक पंपों के क्रिस्टल संरचनाओं का हल भी कर दिया गया, एक व्यापक विवरण देते हुए कि ये आणविक मशीनें कैसे काम करती हैं।[132]
मात्रात्मक मॉडल

गणितीय और कम्प्यूटेशनल मॉडल ऐक्शन पोटेंशिअल को समझने के लिए आवश्यक हैं और ऐसे पूर्वानुमान प्रस्तुत करते हैं जो कि प्रयोगात्मक डेटा के खिलाफ परीक्षण किया जा सकता है, एक सिद्धांत का एक कठोर परीक्षण प्रदान करना। इन मॉडलों में सबसे सही और सबसे महत्वपूर्ण होज्किन-हक्सले मॉडल) है जो चार साधारण अंतर समीकरण (ODEs) द्वारा ऐक्शन पोटेंशिअल का वर्णन करता है।[49] हालांकि होज्किन-हक्सले मॉडल यथार्थवादी तंत्रिका मेम्ब्रेन का एक सरलीकरण हो सकता है क्योंकि यह प्रकृति में मौजूद है, इसकी जटिलता को प्रेरित किया है भी कई और अधिक मॉडल सरलीकृत मॉडल हैं, जैसे मॉरिस-लेकार[133] और फिट्ज़ह्यू-नागुमो मॉडल,[134] जिनमें से दोनों में केवल दो युग्मित ODEs हैं। होज्किन-हक्सले और नागुमो मॉडल और उनके सम्बन्धियों, जैसे बोन्होफर-वैन डेर पोल मॉडल[135] के गुणों का गणित के भीतर अच्छा अध्ययन किया गया है,[136] अभिकलन[137] और इलेक्ट्रॉनिक्स में भी.[138] अधिक आधुनिक अनुसंधानों ने बड़े और एकीकृत प्रणालियों पर अधिक ध्यान केंद्रित किया है और जिसके तहत उन्होंने तंत्रिका प्रणाली के अन्य भागों के साथ ऐक्शन पोटेंशिअल को जोड़ा है (जैसे डेन्ड्राइट और सिनेप्सेस) और इस तरह शोध से अभिकलन तंत्रिका का अध्ययन कर सकते हैं[139] और सरल रिफ्लेक्स का भी, जैसे इस्केप रिफ्लेक्सेस जो सेन्ट्रल पैटर्न जनरेटर द्वारा नियंत्रित होता है।[140][141]
इन्हें भी देखें
- बर्स्टिंग
- सिग्नल (जीव विज्ञान)
- केंद्रीय पैटर्न जनरेटर
टिप्पणियां
- ↑ झिल्ली क्षमता को कोशिका के बाह्य के सापेक्ष परिभाषित किया गया है, इस प्रकार, -70 mV का एक पोटेंशिअल का तात्पर्य है कि सेल अपने बाह्य की तुलना में ऋणात्मक है।
- ↑ ध्यान दें कि ये पुर्किन्जे फाइबर मांसपेशी फाइबर होते हैं और ये पुर्किन्जे कोशिका से संबंधित नहीं होते जो न्यूरॉन होते हैं जो सेरिबुलोकम में पाए जाते हैं।
सन्दर्भ
- ↑ MacDonald PE, Rorsman P (2006). "Oscillations, intercellular coupling, and insulin secretion in pancreatic beta cells". PLoS Biol. 4 (2): e49. PMID 16464129. डीओआइ:10.1371/journal.pbio.0040049. पी॰एम॰सी॰ 1363709. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Barnett MW, Larkman PM (2007). "The action potential". Pract Neurol. 7 (3): 192–7. PMID 17515599. मूल से 8 जुलाई 2011 को पुरालेखित. अभिगमन तिथि 17 सितंबर 2010. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ अ आ बुलोक ओर्कंड और ग्रीनल, पीपी 150-151.; जुंग, पीपी 89-90.; श्मिद-नीलसन, पी. 484.
- ↑ अ आ इ पूर्वेस एट अल., 48-49. पीपी, बुलोक, ओर्कंड और ग्रिनेल, पीपी 141., 150-151, श्मिट-नीलसन, पी. 483; जुंग, पी. 89; स्टीवेंस, पी. 127
- ↑ सामान्य में, जबकि ऐक्शन पोटेंशिअल का यह सरल वर्णन सटीक है, यह बड़ा कदम है वर्तमान के साथ उन्हें समझा नहीं घटनाएं ऐसी प्रेरक के रूप में ऐक्शन पोटेंशिअल को (न्यूरॉन्स को रोकने की क्षमता) के लिए उत्तेजना को ब्लॉक करता है और क्षमता को प्रकाश में लाना संक्षिप्त झिल्ली उच्च विध्रुवन द्वारा ऐक्शन पोटेंशिअल होता है। हालांकि झिल्ली में एक चैनल सोडियम और पोटेशियम की एक प्रणाली की गतिशीलता का विश्लेषण करके पैच का उपयोग कम्प्यूटेशनल मॉडल में किया जाता है, इन घटनाओं को http://www.scholarpedia.org/article/FitzHugh-Nagumo_model Archived 2010-08-21 at the वेबैक मशीन) में समझाया गया है।
- ↑ श्मिट-नीलसन, पी. 484.
- ↑ Golding NL, Kath WL, Spruston N (2001). "Dichotomy of action-potential backpropagation in CA1 pyramidal neuron dendrites". J. Neurophysiol. 86 (6): 2998–3010. PMID 11731556. मूल से 22 नवंबर 2008 को पुरालेखित. अभिगमन तिथि 17 सितंबर 2010. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Campbell Biology, 6th edition
- ↑ जॉनसन और वू, पी. 9.
- ↑ अ आ बुलोक, ओर्कंड और ग्रिनेल, पीपी 140-41..
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पीपी 153-54..
- ↑ Mummert H, Gradmann D (1991). "Action potentials in Acetabularia: measurement and simulation of voltage-gated fluxes". Journal of Membrane Biology. 124 (3): 265–73. PMID 1664861. डीओआइ:10.1007/BF01994359.
- ↑ श्मिट-नीलसन, पी. 483.
- ↑ Lieb WR, Stein WD (1986). "Chapter 2. Simple Diffusion across the Membrane Barrier". Transport and Diffusion across Cell Membranes. San Diego: Academic Press. पपृ॰ 69–112. आई॰ऍस॰बी॰ऍन॰ 0-12-664661-9.
- ↑ अ आ D Purves, GJ Augustine, D Fitzpatrick, WC Hall, A-S LaMantia, JO McNamara, LE White (2007). [http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=neurosci.chapter.227 Neuroscience] (4th संस्करण). Sunderland, MA: Sinauer Associates. आई॰ऍस॰बी॰ऍन॰ 978-0-87893-697-7. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
|title=में बाहरी कड़ी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ CRC Handbook of Chemistry and Physics, 83rd edition, ISBN 0-8493-0483-0, pp. 12–14 to 12–16.
- ↑ अ आ Doyle DA, Morais Cabral J, Pfuetzner RA, Kuo A, Gulbis JM, Cohen SL; एवं अन्य (1998). "The structure of the potassium channel, molecular basis of K+ conduction and selectivity". Science. 280 (5360): 69–77. PMID 9525859. डीओआइ:10.1126/science.280.5360.69. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Zhou Y, Morias-Cabrak JH, Kaufman A, MacKinnon R (2001). "Chemistry of ion coordination and hydration revealed by a K+-Fab complex at 2.0 A resolution". Nature. 414 (6859): 43–48. PMID 11689936. डीओआइ:10.1038/35102009.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Jiang Y, Lee A, Chen J, Ruta V, Cadene M, Chait BT, MacKinnon R (2003). "X-ray structure of a voltage-dependent K+ channel". Nature. 423 (6935): 33–41. PMID 12721618. डीओआइ:10.1038/nature01580.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Eisenman G (1961). "On the elementary atomic origin of equilibrium ionic specificity". प्रकाशित A Kleinzeller, A Kotyk, eds. (संपा॰). Symposium on Membrane Transport and Metabolism. New York: Academic Press. पपृ॰ 163–79.सीएस1 रखरखाव: editors प्राचल का प्रयोग (link)Eisenman G (1965). "Some elementary factors involved in specific ion permeation". Proc. 23rd Int. Congr. Physiol. Sci., Tokyo. Amsterdam: Excerta Med. Found. पपृ॰ 489–506.
Diamond JM, Wright EM (1969). "Biological membranes: the physical basis of ion and nonekectrolyte selectivity". Annual Review of Physiology. 31: 581–646. PMID 4885777. डीओआइ:10.1146/annurev.ph.31.030169.003053. - ↑ जुंग, पीपी 33-37..
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पी. 132.
- ↑ Cai SQ, Li W, Sesti F (2007). "Multiple modes of a-type potassium current regulation". Curr. Pharm. Des. 13 (31): 3178–84. PMID 18045167. डीओआइ:10.2174/138161207782341286.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ अ आ Goldin AL (2007). "Neuronal Channels and Receptors". प्रकाशित Waxman SG (संपा॰). Molecular Neurology. Burlington, MA: Elsevier Academic Press. पपृ॰ 43–58. आई॰ऍस॰बी॰ऍन॰ 978-0-12-369509-3.
- ↑ अ आ इ Hodgkin AL, Keynes RD (1955). "Active transport of cations in giant axons from Sepia and Loligo". J. Physiol. 128 (1): 28–60. PMID 14368574. पी॰एम॰सी॰ 1365754.
- ↑ अ आ Caldwell PC, Hodgkin AL, Keynes RD, Shaw TI (1960). "The effects of injecting energy-rich phosphate compounds on the active transport of ions in the giant axons of Loligo". J. Physiol. 152: 561–90. PMID 13806926. पी॰एम॰सी॰ 1363339.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Steinbach HB, Spiegelman S (1943). "The sodium and potassium balance in squid nerve axoplasm". J. Cell. Comp. Physiol. 22: 187–96. डीओआइ:10.1002/jcp.1030220209.
- ↑ अ आ Hodgkin AL (1951). "The ionic basis of electrical activity in nerve and muscle". Biol. Rev. 26: 339–409. डीओआइ:10.1111/j.1469-185X.1951.tb01204.x.
- ↑ पूर्वेस एट अल., 28-32. पीपी, बुलोक, ओर्कंड और ग्रिनेल, पीपी 133-134.; श्मिट-नीलसन, पीपी. 478-480, 596-597, जुंग पीपी. 33-35
- ↑ अ आ Bernstein J (1902). "Untersuchungen zur Thermodynamik der bioelektrischen Ströme". Pflüger's Arch. Ges. Physiol. 92: 521–562. डीओआइ:10.1007/BF01790181.
* Bernstein J (1912). Elektrobiologie. Braunschweig: Vieweg und Sohn. - ↑ पूर्वेस एट अल., 32-33. पीपी, बुलोक, ओर्कंड और ग्रिनेल, पीपी 138-140.; श्मिट-नीलसन, पीपी 480.; जुंग, पीपी. 35-37
- ↑ अ आ इ Goldman DE (1943). "Potential, impedance and rectification in membranes". J. Gen. Physiol. 27 (1): 37–60. PMID 19873371. डीओआइ:10.1085/jgp.27.1.37. पी॰एम॰सी॰ 2142582.
- ↑ Spangler SG (1972). "Expansion of the constant field equation to include both divalent and monovalent ions". Ala J Med Sci. 9 (2): 218–23. PMID 5045041.
- ↑ अ आ पूर्वेस एट अल., पी 34, बुलोक, ओर्कंड और ग्रिनेल, पी. 134; श्मिट-नीलसन, पीपी 478-480..
- ↑ अ आ Hodgkin AL, Katz B (1949). "The effect of sodium ions on the electrical activity of the giant axon of the squid". J. Physiology. 108: 37–77.
- ↑ पूर्वेस एट अल., 33-36. पीपी, बुलोक, ओर्कंड और ग्रिनेल, पी. 131.
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पी. 11.
- ↑ अ आ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;rising_phaseनाम के संदर्भ में जानकारी नहीं है। - ↑ बुलोक, ओर्कंड और ग्रिनेल, पीपी 177-240.; श्मिट-नीलसन, पीपी 490-499.; स्टीवेंस, पीपी. 47-68.
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पीपी 178-180.; श्मिट-नीलसन, पीपी. 490-491.
- ↑ श्मिट-नीलसन, पीपी 535-580.; बुलोक, ओर्कंड और ग्रिनेल, पीपी 49-56., 76-93, 247-255, स्टीवेंस, 69-79
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पीपी 53., 122-124.
- ↑ जुंग, पीपी 115-132.
- ↑ अ आ बुलोक, ओर्कंड और ग्रिनेल, पीपी 152-153..
- ↑ Noble D (1960). "Cardiac action and pacemaker potentials based on the Hodgkin-Huxley equations". Nature. 188: 495–497. PMID 13729365. डीओआइ:10.1038/188495b0.
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पीपी 444-445..
- ↑ पूर्वेस एट अल., पी 38.
- ↑ स्टीवेंस, पीपी 127-128..
- ↑ पूर्वेस एट अल., पीपी. 61-65.
- ↑ पूर्वेस एट अल., 64-74. पीपी, बुलोक, ओर्कंड और ग्रिनेल, पीपी 149-150.; जुंग, पीपी 84-85.; स्टीवेंस, पीपी 152-158..
- ↑ अ आ इ ई उ Hodgkin AL, Huxley AF, Katz B (1952). "Measurements of current-voltage relations in the membrane of the giant axon of Loligo". Journal of Physiology. 116 (4): 424–448. PMID 14946713. पी॰एम॰सी॰ 1392213.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Hodgkin AL, Huxley AF (1952). "Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo". Journal of Physiology. 116 (4): 449–472. PMID 14946713. पी॰एम॰सी॰ 1392213.
* Hodgkin AL, Huxley AF (1952). "The components of membrane conductance in the giant axon of Loligo". J Physiol. 116 (4): 473–496. PMID 14946714. पी॰एम॰सी॰ 1392209.
* Hodgkin AL, Huxley AF (1952). "The dual effect of membrane potential on sodium conductance in the giant axon of Loligo". J Physiol. 116 (4): 497–506. PMID 14946715. पी॰एम॰सी॰ 1392212.
* Hodgkin AL, Huxley AF (1952). "A quantitative description of membrane current and its application to conduction and excitation in nerve". J Physiol. 117 (4): 500–544. PMID 12991237. पी॰एम॰सी॰ 1392413. - ↑ अ आ इ पूर्वेस एट अल., पीपी. 47, 65, बुलोक, ओर्कंड और ग्रिनेल, पीपी 147-148.; स्टीवेंस, पी. 128.
- ↑ The Royal Swedish Academy of Science (1963). The Nobel Prize in Physiology or Medicine 1963. प्रेस रिलीज़. http://nobelprize.org/nobel_prizes/medicine/laureates/1963/index.html. अभिगमन तिथि: 2010-02-21.
- ↑ Naundorf B, Wolf F, Volgushev M (2006). "Unique features of action potential initiation in cortical neurons" (Letter). Nature. 440 (7087): 1060–1063. PMID 16625198. डीओआइ:10.1038/nature04610. मूल से 3 जुलाई 2017 को पुरालेखित. अभिगमन तिथि 2008-03-27. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ स्टीवेंस, पी. 49.
- ↑ पूर्वेस एट अल., 49-50. पीपी, बुलोक, ओर्कंड और ग्रिनेल, पीपी 140-141., 150-151, श्मिट-नीलसन पीपी. 480-481, 483-484, पीपी जुंग. 89-90.
- ↑ अ आ इ पूर्वेस एट अल., पी 49, बुलोक, ओर्कंड, ग्रिनेल, पी. 151; स्टीवेंस, पीपी 19-20.; जुंग, पीपी. 4-5.
- ↑ अ आ पूर्वेस एट अल., पी 49, बुलोक, ओर्कंड और ग्रिनेल, पीपी 147-149., 152, श्मिट-नीलसन, पीपी. 483-484; स्टीवेंस, पीपी. 126-127.
- ↑ पूर्वेस एट अल., पी 37, बुलोक, ओर्कंड और ग्रिनेल, पी. 152.
- ↑ अ आ पूर्वेस एट अल., पी 56.
- ↑ बुलोक, ओर्कलैंड और ग्रिनेल, पीपी 160-64..
- ↑ Hodgkin AL (1937). "Evidence for electrical transmission in nerve, Part I". Journal of Physiology. 90 (2): 183–210. PMID 16994885. पी॰एम॰सी॰ 1395060.
* Hodgkin AL (1937). "Evidence for electrical transmission in nerve, Part II". Journal of Physiology. 90 (2): 211–32. PMID 16994886. पी॰एम॰सी॰ 1395062. - ↑ स्टीवेंस, पीपी 19-20..
- ↑ स्टीवेंस, pp. 21-23.
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पीपी 161-164..
- ↑ बुलोक, ओर्कंड और ग्रिनेल, पी. 509.
- ↑ Zalc B (2006). "The acquisition of myelin: a success story". Novartis Found. Symp. 276: 15–21, discussion 21–5, 54–7, 275–81. PMID 16805421. डीओआइ:10.1002/9780470032244.ch3.
- ↑ S. Poliak & E. Peles (2006). "The local differentiation of myelinated axons at nodes of Ranvier". Nature Reviews Neuroscience. 12 (4): 968–80. PMID 14682359. डीओआइ:10.1038/nrn1253.
- ↑ Simons M, Trotter J (2007). "Wrapping it up: the cell biology of myelination". Curr. Opin. Neurobiol. 17 (5): 533–40. PMID 17923405. डीओआइ:10.1016/j.conb.2007.08.003. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Xu K, Terakawa S (1 अगस्त 1999). "Fenestration nodes and the wide submyelinic space form the basis for the unusually fast impulse conduction of shrimp myelinated axons". J. Exp. Biol. 202 (Pt 15): 1979–89. PMID 10395528. मूल से 24 मार्च 2020 को पुरालेखित. अभिगमन तिथि 17 सितंबर 2010.
- ↑ अ आ Hursh JB (1939). "Conduction velocity and diameter of nerve fibers". American Journal of Physiology. 127: 131–39.
- ↑ Lillie RS (1925). "Factors affecting transmission and recovery in passive iron nerve model". J. Gen. Physiol. 7 (4): 473–507. PMID 19872151. डीओआइ:10.1085/jgp.7.4.473. पी॰एम॰सी॰ 2140733. यह भी देखें कीन्स और एडले, पी. 78.
- ↑ Tasaki I (1939). "Electro-saltatory transmission of nerve impulse and effect of narcosis upon nerve fiber". Amer. J. Physiol. 127: 211–27.
- ↑ Tasaki I, Takeuchi T (1941). "Der am Ranvierschen Knoten entstehende Aktionsstrom und seine Bedeutung für die Erregungsleitung". Pflüger's Arch. Ges. Physiol. 244: 696–711. डीओआइ:10.1007/BF01755414.
* Tasaki I, Takeuchi T (1942). "Weitere Studien über den Aktionsstrom der markhaltigen Nervenfaser und über die elektrosaltatorische Übertragung des nervenimpulses". Pflüger's Arch. Ges. Physiol. 245: 764–82. डीओआइ:10.1007/BF01755237.
* Tasaki I (1959). J Field, HW Magoun, VC Hall (संपा॰). Handbook of Physiology: Neurophysiology ((sect. 1, vol. 1) संस्करण). Washington, D.C.: American Physiological Society. पपृ॰ 75–121.सीएस1 रखरखाव: एक से अधिक नाम: editors list (link) - ↑ Huxley A, Stämpfli R (1949). "Evidence for saltatory conduction in peripheral myelinated nerve-fibers". Journal of Physiology. 108: 315–39.
* Huxley A, Stämpfli R (1949). "Direct determination of membrane resting potential and action potential in single myelinated nerve fibers". Journal of Physiology. 112 (3–4): 476–95. PMID 14825228. पी॰एम॰सी॰ 1393015. - ↑ Schmidt-Nielsen, Figure 12.13.
- ↑ [138]
- ↑ अ आ Hartline DK, Colman DR (2007). "Rapid conduction and the evolution of giant axons and myelinated fibers". Curr. Biol. 17 (1): R29–R35. PMID 17208176. डीओआइ:10.1016/j.cub.2006.11.042.
- ↑ बुलोक, ओर्कलैंड और ग्रिनेल, पी. 163.
- ↑ Miller RH, Mi S (2007). "Dissecting demyelination". Nat. Neurosci. 10 (11): 1351–54. PMID 17965654. डीओआइ:10.1038/nn1995.
- ↑ Waxman SG (2007). "Multiple Sclerosis as a Neurodegenerative Disease". प्रकाशित Waxman SG (संपा॰). Molecular Neurology. Burlington, MA: Elsevier Academic Press. पपृ॰ 333–46. आई॰ऍस॰बी॰ऍन॰ 978-0-12-369509-3.
- ↑ अ आ Rall W (1989). "Cable Theory for Dendritic Neurons". प्रकाशित C. Koch and I. Segev (संपा॰). Methods in Neuronal Modeling: From Synapses to Networks. Cambridge MA: Bradford Books, MIT Press. पपृ॰ 9–62. आई॰ऍस॰बी॰ऍन॰ 0-262-11133-0.
- ↑ Segev I, Fleshman JW, Burke RE (1989). "Compartmental Models of Complex Neurons". प्रकाशित C. Koch and I. Segev (संपा॰). Methods in Neuronal Modeling: From Synapses to Networks. Cambridge MA: Bradford Books, MIT Press. पपृ॰ 63–96. आई॰ऍस॰बी॰ऍन॰ 0-262-11133-0.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Kelvin WT (1855). "On the theory of the electric telegraph". Proceedings of the Royal Society. 7: 382–99. डीओआइ:10.1098/rspl.1854.0093.
- ↑ Hodgkin AL, Rushton WAH (1946). "The electrical constants of a crustacean nerve fibre". Proceedings of the Royal Society B. 133: 444–79. डीओआइ:10.1098/rspb.1946.0024.
- ↑ पूर्वेस एट अल., पीपी. 52-53.
- ↑ Süudhof TC (2008). "Neurotransmitter release". Handb Exp Pharmacol. 184 (184): 1–21. PMID 18064409. डीओआइ:10.1007/978-3-540-74805-2_1.
- ↑ Rusakov DA (2006). "Ca2+-dependent mechanisms of presynaptic control at central synapses". Neuroscientist. 12 (4): 317–26. PMID 16840708. डीओआइ:10.1177/1073858405284672. पी॰एम॰सी॰ 2684670. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Humeau Y, Doussau F, Grant NJ, Poulain B (2000). "How botulinum and tetanus neurotoxins block neurotransmitter release". Biochimie. 82 (5): 427–46. PMID 10865130. डीओआइ:10.1016/S0300-9084(00)00216-9. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Zoidl G, Dermietzel R (2002). "On the search for the electrical synapse: a glimpse at the future". Cell Tissue Res. 310 (2): 137–42. PMID 12397368. डीओआइ:10.1007/s00441-002-0632-x.
- ↑ Brink PR, Cronin K, Ramanan SV (1996). "Gap junctions in excitable cells". J. Bioenerg. Biomembr. 28 (4): 351–8. PMID 8844332. डीओआइ:10.1007/BF02110111.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Hirsch NP (2007). "Neuromuscular junction in health and disease". Br J Anaesth. 99 (1): 132–8. PMID 17573397. डीओआइ:10.1093/bja/aem144. मूल से 21 मई 2020 को पुरालेखित. अभिगमन तिथि 17 सितंबर 2010. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Hughes BW, Kusner LL, Kaminski HJ (2006). "Molecular architecture of the neuromuscular junction". Muscle Nerve. 33 (4): 445–61. PMID 16228970. डीओआइ:10.1002/mus.20440. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ Newmark J (2007). "Nerve agents". Neurologist. 13 (1): 20–32. PMID 17215724. डीओआइ:10.1097/01.nrl.0000252923.04894.53.
- ↑ Costa LG (2006). "Current issues in organophosphate toxicology". Clin. Chim. Acta. 366 (1–2): 1–13. PMID 16337171. डीओआइ:10.1016/j.cca.2005.10.008.
- ↑ अ आ इ Kléber AG, Rudy Y (2004). "Basic mechanisms of cardiac impulse propagation and associated arrhythmias". Physiol. Rev. 84 (2): 431–88. PMID 15044680. डीओआइ:10.1152/physrev.00025.2003. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)[मृत कड़ियाँ] - ↑ Tamargo J, Caballero R, Delpón E (2004). "Pharmacological approaches in the treatment of atrial fibrillation". Curr. Med. Chem. 11 (1): 13–28. PMID 14754423. डीओआइ:10.2174/0929867043456241. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Ganong W (1991). Review of Medical Physiology (15th संस्करण). Norwalk CT: Appleton and Lange. पपृ॰ 59–60. आई॰ऍस॰बी॰ऍन॰ 0-8385-8418-7.
- ↑ Slayman CL, Long WS, Gradmann D (1976). "Action potentials in Neurospora crassa, a mycelial fungus". Biochimica et biophysica acta. 426 (4): 737–744. PMID 130926. डीओआइ:10.1016/0005-2736(76)90138-3.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Mummert H, Gradmann D (1991). "Action potentials in Acetabularia: measurement and simulation of voltage-gated fluxes". Journal of Membrane Biology. 124 (3): 265–273. PMID 1664861. डीओआइ:10.1007/BF01994359.
- ↑ Gradmann D (2001). "Models for oscillations in plants". Austr. J. Plant Physiol. 28: 577–590.
- ↑ Beilby MJ (2007). "Action potentials in charophytes". Int. Rev. Cytol. 257: 43–82. PMID 17280895. डीओआइ:10.1016/S0074-7696(07)57002-6.
- ↑ Gradmann D, Hoffstadt J (1998). "Electrocoupling of ion transporters in plants: Interaction with internal ion concentrations". Journal of Membrane Biology. 166 (1): 51–59. PMID 9784585. डीओआइ:10.1007/s002329900446.
- ↑ Gradmann D, Mummert H (1980). "Plant action potentials". प्रकाशित Spanswick RM, Lucas WJ, Dainty J (संपा॰). Plant Membrane Transport: Current Conceptual Issues. Amsterdam: Elsevier Biomedical Press. पपृ॰ 333–344. आई॰ऍस॰बी॰ऍन॰ 0444801928.सीएस1 रखरखाव: एक से अधिक नाम: editors list (link)
- ↑ Fromm J, Lautner S (2007). "Electrical signals and their physiological significance in plants". Plant Cell Environ. 30 (3): 249–257. PMID 17263772. डीओआइ:10.1111/j.1365-3040.2006.01614.x.
- ↑ Leys SP, Mackie GO, Meech RW (1 मई 1999). "Impulse conduction in a sponge". J. Exp. Biol. 202 (Pt 9) (9): 1139–50. PMID 10101111. मूल से 13 फ़रवरी 2022 को पुरालेखित. अभिगमन तिथि 17 सितंबर 2010.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Bullock TH, Horridge GA (1965). Structure and Function in the Nervous Systems of Invertebrates. San Francisco: W. H. Freeman.
- ↑ Keynes RD (1989). "The role of giant axons in studies of the nerve impulse". BioEssays. 10 (2–3): 90–93. PMID 2541698. डीओआइ:10.1002/bies.950100213.
- ↑ Meunier C, Segev I (2002). "Playing the devil's advocate: is the Hodgkin-Huxley model useful?". Trends Neurosci. 25 (11): 558–63. PMID 12392930. डीओआइ:10.1016/S0166-2236(02)02278-6.
- ↑ Cole KS (1949). "Dynamic electrical characteristics of the squid axon membrane". Arch. Sci. Physiol. 3: 253–8.
- ↑ जुंग, पीपी 63-82..
- ↑ Kettenmann H, Grantyn R (1992). Practical Electrophysiological Methods. New York: Wiley. आई॰ऍस॰बी॰ऍन॰ 978-0471562009. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- ↑ Ling G, Gerard RW (1949). "The normal membrane potential of frog sartorius fibers". J. Cell. Comp. Physiol. 34 (3): 383–396. PMID 15410483. डीओआइ:10.1002/jcp.1030340304.
- ↑ Nastuk WL, Hodgkin AL (1950). "The electrical activity of single muscle fibers". J. Cell. Comp. Physiol. 35: 39–73. डीओआइ:10.1002/jcp.1030350105.
- ↑ Brock LG, Coombs JS, Eccles JC (1952). "The recording of potentials from motoneurones with an intracellular electrode". J. Physiol. (London). 117: 431–460.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Snell FM (1969). "Some Electrical Properties of Fine-Tipped Pipette Microelectrodes". प्रकाशित M. Lavallée, OF Schanne, NC Hébert (संपा॰). Glass Microelectrodes. New York: John Wiley and Sons. LCCN 68-9252.सीएस1 रखरखाव: एक से अधिक नाम: editors list (link)
- ↑ Ross WN, Salzberg BM, Cohen LB, Davila HV (1974). "A large change in dye absorption during the action potential". Biophysical Journal. 14 (12): 983–986. PMID 4429774. डीओआइ:10.1016/S0006-3495(74)85963-1. पी॰एम॰सी॰ 1334592.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Grynkiewicz G, Poenie M, Tsien RY (1985). "A new generation of Ca2+ indicators with greatly improved fluorescence properties". J. Biol. Chem. 260 (6): 3440–3450. PMID 3838314.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ The Royal Swedish Academy of Science (1991). The Nobel Prize in Physiology or Medicine 1991. प्रेस रिलीज़. http://nobelprize.org/nobel_prizes/medicine/laureates/1991/press.html. अभिगमन तिथि: 2010-02-21.
- ↑ Bu G, Adams H, Berbari EJ, Rubart M (2009). "Uniform action potential repolarization within the sarcolemma of in situ ventricular cardiomyocytes". Biophys. J. 96 (6): 2532–46. PMID 19289075. डीओआइ:10.1016/j.bpj.2008.12.3896. पी॰एम॰सी॰ 2907679. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Nakamura Y, Nakajima S, Grundfest H (1965). "The effect of tetrodotoxin on electrogenic components of squid giant axons". J. Gen. Physiol. 48: 985–996. डीओआइ:10.1085/jgp.48.6.975.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Ritchie JM, Rogart RB (1977). "The binding of saxitoxin and tetrodotoxin to excitable tissue". Rev. Physiol. Biochem. Pharmacol. 79: 1–50. PMID 335473. डीओआइ:10.1007/BFb0037088.
* Keynes RD, Ritchie JM (1984). "On the binding of labelled saxitoxin to the squid giant axon". Proc. R. Soc. Lond. 239: 393–434. - ↑ Piccolino M (1997). "Luigi Galvani and animal electricity: two centuries after the foundation of electrophysiology". Trends in Neuroscience. 20: 443–448. डीओआइ:10.1016/S0166-2236(97)01101-6.
- ↑ Piccolino M (2000). "The bicentennial of the Voltaic battery (1800–2000): the artificial electric organ". Trends in Neuroscience. 23: 147–151. डीओआइ:10.1016/S0166-2236(99)01544-1.
- ↑ Brazier MAB (1961). A History of the Electrical Activity of the Brain. London: Pitman.
* McHenry LC (1969). Garrison's History of Neurology. Springfield, IL: Charles C. Thomas.
* Swazey J, Worden FG (1975). Paths of Discovery in the Neurosciences. Cambridge, MA: The MIT Press. - ↑ The Royal Swedish Academy of Science (1906). The Nobel Prize in Physiology or Medicine 1906. प्रेस रिलीज़. http://nobelprize.org/medicine/laureates/1906/index.html. अभिगमन तिथि: 2010-02-21.
- ↑ Cole KS, Curtis HJ (1939). "Electrical impedance of the squid giant axon during activity". J. Gen. Physiol. 22 (5): 649–670. PMID 19873125. डीओआइ:10.1085/jgp.22.5.649. पी॰एम॰सी॰ 2142006.
- ↑ Lapicque L (1907). "Recherches quantitatives sur l'excitationelectrique des nerfs traitee comme une polarisation". J. Physiol. Pathol. Gen. 9: 620–635.
- ↑ Neher E, Sakmann B (1976). "Single-channel currents recorded from membrane of denervated frog muscle fibres". Nature. 260: 779–802.
* Hamill OP, Marty A, Neher E, Sakmann B, Sigworth FJ (1981). "Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches". Pflugers Arch. 391 (2): 85–100. PMID 6270629. डीओआइ:10.1007/BF00656997.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Neher E, Sakmann B (1992). "The patch clamp technique". Scientific American. 266 (3): 44–51. PMID 1374932. डीओआइ:10.1038/scientificamerican0392-44. - ↑ Yellen G (2002). "The voltage-gated potassium channels and their relatives". Nature. 419 (6902): 35–42. PMID 12214225. डीओआइ:10.1038/nature00978.
- ↑ Cha A, Snyder GE, Selvin PR, Bezanilla F (1999). "Atomic-scale movement of the voltage-sensing region in a potassium channel measured via spectroscopy". Nature. 402 (6763): 809–813. PMID 10617201. डीओआइ:10.1038/45552.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Glauner KS, Mannuzzu LM, Gandhi CS, Isacoff E (1999). "Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel". Nature. 402 (6763): 813–817. PMID 10617202. डीओआइ:10.1038/45561.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Bezanilla F (2000). "The voltage sensor in voltage-dependent ion channels". Physiol. Rev. 80 (2): 555–592. PMID 10747201. - ↑ Catterall WA (2001). "A 3D view of sodium channels". Nature. 409 (6823): 988–999. PMID 11234048. डीओआइ:10.1038/35059188.
* Sato C, Ueno Y, Asai K, Takahashi K, Sato M, Engel A; एवं अन्य (2001). "The voltage-sensitive sodium channel is a bell-shaped molecule with several cavities". Nature. 409 (6823): 1047–1051. PMID 11234014. डीओआइ:10.1038/35059098. Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Skou J (1957). "The influence of some cations on an adenosine triphosphatase from peripheral nerves". Biochim Biophys Acta. 23 (2): 394–401. PMID 13412736. डीओआइ:10.1016/0006-3002(57)90343-8., The Royal Swedish Academy of Science (1997). The Nobel Prize in Chemistry 1997. प्रेस रिलीज़. http://nobelprize.org/nobel_prizes/medicine/laureates/1997/press.html. अभिगमन तिथि: 2010-02-21.
- ↑ Caldwell PC, Keynes RD (1957). "The utilization of phosphate bond energy for sodium extrusion from giant axons". J. Physiol. (London). 137: 12–13P.
- ↑ Morth JP, Pedersen PB, Toustrup-Jensen MS, Soerensen TLM, Petersen J, Andersen JP, Vilsen B, Nissen P (2007). "Crystal structure of the sodium–potassium pump". Nature. 450 (7172): 1043–1049. PMID 18075585. डीओआइ:10.1038/nature06419.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Lee AG, East JM (2001). "What the structure of a calcium pump tells us about its mechanism". Biochemical Journal. 356 (Pt 3): 665–683. PMID 11389676. डीओआइ:10.1042/0264-6021:3560665. पी॰एम॰सी॰ 1221895.
- ↑ Morris C, Lecar H (1981). "Voltage oscillations in the barnacle giant muscle fiber". Biophysical Journal. 35 (1): 193–213. PMID 7260316. डीओआइ:10.1016/S0006-3495(81)84782-0. पी॰एम॰सी॰ 1327511.
- ↑ FitzHugh R (1961). "Impulses and physiological states in theoretical models of nerve membrane". Biophysical Journal. 1 (6): 445–466. PMID 19431309. डीओआइ:10.1016/S0006-3495(61)86902-6. पी॰एम॰सी॰ 1366333.
* Nagumo J, Arimoto S, Yoshizawa S (1962). "An active pulse transmission line simulating nerve axon". Proceedings of the IRE. 50: 2061–2070. डीओआइ:10.1109/JRPROC.1962.288235.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Bonhoeffer KF (1948). "Activation of Passive Iron as a Model for the Excitation of Nerve". J. Gen. Physiol. 32 (1): 69–91. PMID 18885679. डीओआइ:10.1085/jgp.32.1.69. पी॰एम॰सी॰ 2213747.
* Bonhoeffer KF (1953). "Modelle der Nervenerregung". Naturwissenschaften. 40: 301–311. डीओआइ:10.1007/BF00632438.
* van der Pol B (1926). "On relaxation-oscillations". Philosophical Magazine. 2: 977–992.
* van der Pol B, van der Mark J (1928). "The heartbeat considered as a relaxation oscillation, and an electrical model of the heart". Philosophical Magazine. 6: 763–775.
* van der Pol B, van der Mark J (1929). "The heartbeat considered as a relaxation oscillation, and an electrical model of the heart". Arch. Neerl. Physiol. 14: 418–443. - ↑ Sato S, Fukai H, Nomura T, Doi S (2005). "Bifurcation Analysis of the Hodgkin-Huxley Equations". प्रकाशित Reeke GN, Poznanski RR, Lindsay KA, Rosenberg JR, Sporns O (संपा॰). Modeling in the Neurosciences: From Biological Systems to Neuromimetic Robotics (2nd संस्करण). Boca Raton: CRC Press. पपृ॰ 459–478. आई॰ऍस॰बी॰ऍन॰ 978-0415328685.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
* Evans JW (1972). "Nerve axon equations. I. Linear approximations". Indiana U. Math. Journal. 21: 877–885. डीओआइ:10.1512/iumj.1972.21.21071.
* Evans JW, Feroe J (1977). "Local stability theory of the nerve impulse". Math. Biosci. 37: 23–50. डीओआइ:10.1016/0025-5564(77)90076-1.
* FitzHugh R (1969). "Mathematical models of axcitation and propagation in nerve". प्रकाशित HP Schwann (संपा॰). Biological Engineering. New York: McGraw-Hill. पपृ॰ 1–85.
* Guckenheimer J, Holmes P (1986). Nonlinear Oscillations, Dynamical Systems and Bifurcations of Vector Fields (2nd printing, revised and corrected संस्करण). New York: Springer Verlag. पपृ॰ 12–16. आई॰ऍस॰बी॰ऍन॰ 0-387-90819-6. - ↑ Nelson ME, Rinzel J (1994). "The Hodgkin-Huxley Model" (PDF). प्रकाशित Bower J, Beeman D (संपा॰). The Book of GENESIS: Exploring Realistic Neural Models with the GEneral NEural SImulation System. New York: Springer Verlag. पपृ॰ 29–49.
Rinzel J, Ermentrout GB (1989). "Analysis of Neural Excitability and Oscillations". प्रकाशित C. Koch, I Segev (संपा॰). Methods in Neuronal Modeling: From Synapses to Networks. Cambridge, MA: Bradford Book, The MIT Press. पपृ॰ 135–169. आई॰ऍस॰बी॰ऍन॰ 0-262-11133-0. - ↑ Keener JP (1983). "Analogue circuitry for the van der Pol and FitzHugh-Nagumo equations". IEEE Trans. on Systems, Man and Cybernetics. 13: 1010–1014.
- ↑ McCulloch WS (1988). Embodiments of Mind. Cambridge MA: The MIT Press. पपृ॰ 19–39, 46–66, 72–141. आई॰ऍस॰बी॰ऍन॰ 0-262-63114-8.
* edited by James A. Anderson and Edward Rosenfeld. (1988). JA Anderson, E Rosenfeld (संपा॰). Neurocomputing:Foundations of Research. Cambridge, MA: The MIT Press. पपृ॰ 15–41. आई॰ऍस॰बी॰ऍन॰ 0-262-01097-6.सीएस1 रखरखाव: फालतू पाठ: authors list (link) सीएस1 रखरखाव: editors प्राचल का प्रयोग (link) - ↑ Getting PA (1989). "Reconstruction of Small Neural Networks". प्रकाशित C Koch and I Segev (संपा॰). Methods in Neuronal Modeling: From Synapses to Networks. Cambridge, MA: Bradford Book, The MIT Press. पपृ॰ 171–194. आई॰ऍस॰बी॰ऍन॰ 0-262-11133-0.
- ↑ Hooper SL (2000). "Central pattern generators". Curr. Biol. 10 (5): R176. PMID 10713861. डीओआइ:10.1016/S0960-9822(00)00367-5. मूल से 20 जुलाई 2011 को पुरालेखित. अभिगमन तिथि 17 सितंबर 2010. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)
सन्दर्भग्रंथ सूची
- Aidley DJ, Stanfield PR (1996). Ion Channels: Molecules in Action. Cambridge: Cambridge University Press. आई॰ऍस॰बी॰ऍन॰ 978-0521498821. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Bear MF, Connors BW, Paradiso MA (2001). Neuroscience: Exploring the Brain. Baltimore: Lippincott. आई॰ऍस॰बी॰ऍन॰ 0781739446. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Bullock TH, Orkand R, Grinnell A (1977). Introduction to Nervous Systems. New York: W. H. Freeman. आई॰ऍस॰बी॰ऍन॰ 0-7167-0030-1. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Clay JR (2005). "Axonal excitability revisited". Prog Biophys Mol Biol. 88 (1): 59–90. PMID 15561301. डीओआइ:10.1016/j.pbiomolbio.2003.12.004. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - Deutsch S, Micheli-Tzanakou E (1987). Neuroelectric Systems. New York: New York University Press. आई॰ऍस॰बी॰ऍन॰ 0-8147-1782-9. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Hille B (2001). Ion Channels of Excitable Membranes (3rd संस्करण). Sunderland, MA: Sinauer Associates. आई॰ऍस॰बी॰ऍन॰ 978-0878933211. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Hoppensteadt FC (1986). An Introduction to the Mathematics of Neurons. Cambridge: Cambridge University Press. आई॰ऍस॰बी॰ऍन॰ 0-521-31574-3. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Johnston D, Wu SM-S (1995). Foundations of Cellular Neurophysiology. Cambridge, MA: Bradford Book, The MIT Press. आई॰ऍस॰बी॰ऍन॰ 0-262-10053-3. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Junge D (1981). Nerve and Muscle Excitation (2nd संस्करण). Sunderland MA: Sinauer Associates. आई॰ऍस॰बी॰ऍन॰ 0-87893-410-3.
- Kandel ER, Schwartz JH, Jessell TM (2000). Principles of Neural Science (4th संस्करण). New York: McGraw-Hill. आई॰ऍस॰बी॰ऍन॰ 0-8385-7701-6.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Keynes RD, Aidley DJ (1991). Nerve and Muscle (2nd संस्करण). Cambridge: Cambridge University Press. आई॰ऍस॰बी॰ऍन॰ 0-521-41042-8. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Miller C (1987). "How ion channel proteins work". प्रकाशित LK Kaczmarek, IB Levitan (संपा॰). Neuromodulation: The Biochemical Control of Neuronal Excitability. New York: Oxford University Press. पपृ॰ 39–63. आई॰ऍस॰बी॰ऍन॰ 978-0195040975.
- Nelson DL, Cox MM (2008). Lehninger Principles of Biochemistry (5th संस्करण). New York: W. H. Freeman. आई॰ऍस॰बी॰ऍन॰ 978-0-7167-7108-1. मूल से 19 मार्च 2015 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia A-S, McNamara JO, Williams SM (2001). "Release of Transmitters from Synaptic Vesicles". Neuroscience (2nd संस्करण). Sunderland, MA: Sinauer Associates. आई॰ऍस॰बी॰ऍन॰ 0878937250. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia A-S, McNamara JO, White LE (2008). Neuroscience (4th संस्करण). Sunderland, MA: Sinauer Associates. आई॰ऍस॰बी॰ऍन॰ 978-0-87893-697-7.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Schmidt-Nielsen K (1997). Animal Physiology: Adaptation and Environment (5th संस्करण). Cambridge: Cambridge University Press. आई॰ऍस॰बी॰ऍन॰ 978-0521570985. मूल से 2 अक्तूबर 2019 को पुरालेखित. अभिगमन तिथि 23 अक्तूबर 2019.
- Stevens CF (1966). Neurophysiology: A Primer. New York: John Wiley and Sons. LCCN 66-15872 .
बाहरी कड़ियाँ
- एनिमेशन
- ब्लैकवेल प्रकाशन पर आयनिक फ्लो इन एक्शन पोटेंशिअल
- ब्लैकवेल प्रकाशन पर एक्शन पोटेंशिअल प्रोपोगेशन इन मेलिनेटेड एंड अनमेलिनेटेड ऐक्सन
- जनरेशन ऑफ़ एपी इन कार्डिएक सेल और जनरेशन ऑफ़ एपी इन न्यूरॉन सेल
- रेस्टिग मेम्ब्रेन पोटेन्शियल लाइफ: द साइंस ऑफ़ बायोलोजी द्वारा डब्लूके पूर्वेस, फ्रीमन, डी सदवा, जीएच ओरिंस और एचसी हेलर, 8 संस्करण, न्यूयॉर्क, ISBN 978-0-7167-7671-0.
- आयनिक मोशन एंड गोल्डमन वोल्टेज फॉर अर्बित्रारी आयनिक कंसंट्रेशन एरिजोना विश्वविद्यालय में
- एक्शन पोटेंशिअल को दर्शाता एक चित्र
- ऐक्शन पोटेंशिअल प्रसार
- एक्शन पोटेंशिअल का उत्पादन: वोल्टेज और करेंट क्लेम्पिंग सिमुलेशन [मृत कड़ियाँ]
- ओपन-सोर्स सॉफ्टवेर टु सिमुलेट नयूरोनल एंड कार्डिअक एक्शन पोटेंशिअल SourceForge.net पर
- इंट्रोडक्शन टु एक्शन पोटेंशिअल, न्यूरोसाइंस ऑनलाइन (ह्यूस्टन मेडिकल स्कूल केन्द्र शासित प्रदेशों के इलेक्ट्रॉनिक तंत्रिका विज्ञान की पाठ्यपुस्तक द्वारा)
![{\displaystyle E_{eq,K^{+}}={\frac {RT}{zF}}\ln {\frac {[K^{+}]_{o}}{[K^{+}]_{i}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)
![{\displaystyle E_{m}={\frac {RT}{F}}\ln {\left({\frac {P_{\mathrm {K} }[\mathrm {K} ^{+}]_{\mathrm {out} }+P_{\mathrm {Na} }[\mathrm {Na} ^{+}]_{\mathrm {out} }+P_{\mathrm {Cl} }[\mathrm {Cl} ^{-}]_{\mathrm {in} }}{P_{\mathrm {K} }[\mathrm {K} ^{+}]_{\mathrm {in} }+P_{\mathrm {Na} }[\mathrm {Na} ^{+}]_{\mathrm {in} }+P_{\mathrm {Cl} }[\mathrm {Cl} ^{-}]_{\mathrm {out} }}}\right)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b29151571b6fb807674bf342d01f178908a1a98)



