कार्बनिक रसायन

कार्बनिक रसायन, प्रांगार रसायन, या प्रांगारिकी (अंग्रेज़ी: Organic chemistry, लिप्यंतरण: ऑर्गैनिक कैमिस्ट्री) रसायन विज्ञान की एक प्रमुख शाखा है, दूसरी प्रमुख शाखा है - अकार्बनिक रसायन। कार्बनिक [1] रसायन का सम्बन्ध मुख्यतः कार्बन और हाइड्रोजन के अणुओं वाले रासायनिक यौगिकों के संरचना, गुणधर्म, रासायनिक अभिक्रियाओं एवं उनके निर्माण (संश्लेषण या सिन्थेसिस एवं अन्य प्रक्रिया द्वारा) आदि के वैज्ञानिक अध्ययन से है। कार्बनिक यौगिकों में कार्बन और हाइड्रोजन के अतिरिक्त अन्य अणु भी हो सकते हैं, जैसे- नाइट्रोजन (नत्रजन), ऑक्सीजन, हैलोजन, फॉस्फोरस, सिलिकॉन, गंधक(सल्फर) आदि।
इतिहास
- 1675: लेमरी ने प्राकृतिक रूप से प्राप्त रसायनों को उनके स्रोत के अनुसार तीन भागों में बाँटा - खनिज, वानस्पतिक, जन्तुओं से प्राप्त।
- 1784: एंटॉनी लैवाशिए (Antoine Lavoisier) ने प्रदर्शित किया कि वनस्पतियों एवं जन्तुओं से प्राप्त सभी उत्पाद मुख्यतः कार्बन और हाइड्रोजन से बने हैं। इसके अलावा कुछ में नाइट्रोजन, आक्सीजन और गंधक भी कुछ मात्रा में होते हैं।
- 1807: बर्जीलियस ने रसायनों को दो भागों में बाँटा-
- कार्बनिक (ऑर्गैनिक) - जो जन्तुओं तथा पेड़-पौधों से प्राप्त होते हैं, तथा
- अकार्बनिक (इनऑर्गैनिक)- जो निर्जीव पदार्थों से प्राप्त किये जाते हैं।
- 1816: माइअकल इजीन चेब्रूल (Michel Eugène Chevreul) ने विभिन्न स्रोतों से प्राप्त वसा अम्लों तथा विभिन्न क्षारों द्वारा कई तरह के साबुन बनाए। अतः ये सबसे पहले निर्मित कार्बनिक पदार्थ थे जो प्राकृतिक (जीवों) से प्राप्त पदार्थों द्वारा बनाये गये थे।
- 1828: फ्रेडरिक वुहलर (Friedrich Wöhler) ने सामान्य प्रयोगशाला तकनीकों का उपयोग करते हुए, अकार्बनिक पदार्थों से यूरिया का संश्लेषण किया। यह अमोनियम आक्जलेट के बाद द्वितीय कार्बनिक पदार्थ था जो कृत्रिम रूप से बनाया गया था।
- 1856: विलियम पर्किन ने संयोग से (by accident) प्रथम कार्बनिक रंजक का निर्माण किया।
- ''2023अभिषेक मौर्य ने बताया कि कार्बनिक रसायन को बनाने के लिए ऑक्सीजन तथा नाइट्रोजन के साथ गंधक और अनेक अम्ल जैसे मेथेन,हाइड्रोक्लोरिक अम्ल, हाइड्रोजन का प्रयोग होता है।
जिससे हमे भूमि में उर्वरता प्रदान होती है।
कार्बनिक यौगिक
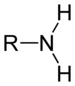
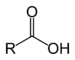
कार्बनिक यौगिक कार्बन, हाइड्रोजन और अन्य तत्वों से मिलकर बने यौगिकों को कहते हैं। इनके बीच प्रायः सहसंयोजक बंध होते हैं और ये कार्बनिक विलयनों में ही विलेय (घुलनशील) होते हैं। इनके उदाहरण हैं - मेथेन, क्लोरोफ़ॉर्म, एसीटिक अम्ल, कार्बोहाईड्रेट, यूरिया इत्यादि। इनकी उपस्थिति जैव पदार्थों में अधिक होती है। प्रमुख कार्बनिक यौगिकों के समूह हैं - एल्केन्स, अल्काइन्स, अल्कोहल, एल्कोइक एसिड, अल्डीहाइड, कीटोन, ईथर, एस्टर, एल्काइल साइनाइड, एल्काइल एमाइड इत्यादि। प्रकृति में कार्बनिक यौगिकों की संख्या 10 लाख से भी अधिक है। जीवन पद्धति में कार्बनिक यौगिकों की बहुत ही महत्वपूर्ण भूमिका है। इनमें कार्बन के साथ-साथ हाइड्रोजन भी रहता है। ऐतिहासिक तथा परंपरागत कारणों से कुछ कार्बन के यौगकों को कार्बनिक यौगिकों की श्रेणी में नहीं रखा जाता है। इनमें कार्बनडाइऑक्साइड, कार्बन मोनोऑक्साइड प्रमुख हैं। सभी जैव अणु जैसे कार्बोहाइड्रेट, अमीनो अम्ल, प्रोटीन, आरएनए तथा डीएनए कार्बनिक यौगिक ही हैं। कार्बन और हाइड्रोजन के यौगिको को हाइड्रोकार्बन कहते हैं। मिथेन (CH4) सबसे छोटे अणुसूत्र का हाइड्रोकार्बन है। ईथेन (C2H6), प्रोपेन (C3H8) आदि इसके बाद आते हैं, जिनमें क्रमश: एक एक कार्बन जुड़ता जाता है। हाइड्रोकार्बन तीन श्रेणियों में विभाजित किए जा सकते हैं: ईथेन श्रेणी, एथिलीन श्रेणी और ऐसीटिलीन श्रेणी। ईथेन श्रेणी के हाइड्रोकार्बन संतृप्त हैं, अर्थात् इनमें हाइड्रोजन की मात्रा और बढ़ाई नहीं जा सकती। एथिलीन में दो कार्बनों के बीच में एक द्विबंध (=) है, ऐसीटिलीन में त्रिगुण बंध (º) वाले यौगिक अस्थायी हैं। ये आसानी से ऑक्सीकृत एवं हैलोजनीकृत हो सकते हैं। हाइड्रोकार्बनों के बहुत से व्युत्पन्न तैयार किए जा सकते हैं, जिनके विविध उपयोग हैं। ऐसे व्युत्पन्न क्लोराइड, ब्रोमाइड, आयोडाइड, ऐल्कोहाल, सोडियम ऐल्कॉक्साइड, ऐमिन, मरकैप्टन, नाइट्रेट, नाइट्राइट, नाइट्राइट, हाइड्रोजन फास्फेट तथा हाइड्रोजन सल्फेट हैं। असत से व्युत्पन्न बनाता है। ऐसे अनेक व्युत्पंन औद्योगिक दृष्टि से बड़े महत्व के सिद्ध हुए हैं। इनसे अनेक बहुमूल्य विलायक, प्लास्टिक, कृमिनाशक ओषधियाँ आदि प्राप्त हुई हैं। हाइड्रोकार्बनों के ऑक्सीकरण से ऐल्कोहॉल, ईथर, कीटोन, ऐल्डीहाइड, वसा अम्ल, एस्टर आदि प्राप्त होते हैं। ऐल्कोहॉल प्राथमिक, द्वितीयक और तृतीयक हो सकते हैं। इनके एस्टर द्रव सुगंधित होते हैं। अनेक सुगंधित द्रव्य इनसे तैयार किए जा सकते हैं।
कार्बनिक यौगिकों में संयोजकता एवं समावयवता

संयोजकताएँ (जिनके द्वारा अणु में परमाणु एक दूसरे के साथ संबद्ध होते हैं) दो प्रकार की होती हैं : वैद्युत् संयोजकता (electrovalency) और सहसंयोजकता (covalency)। अकार्बनिक लवणों में अणु में परमाणु, या मूलक, बहुधा विद्युत् संयोजकता द्वारा संबद्ध रहते हैं और ये अणु न केवल विलयनों में ही आयनों में विभक्त हो जाते हैं, बल्कि ठोस क्रिस्टलों में भी इनके आयन विशेष स्थिति में विद्यमान रहते हैं।
कार्बन परमाणु की बाह्यतम परिधि पर चार इलेक्ट्रॉन (.) हैं। यह अपने चारों ओर चार और इलेक्ट्रॉन लेकर अपना अष्टक पूरा कर सकता है। एक कार्बन परमाणु इस प्रकार चार हाइड्रोजनों से भी संयुक्त हो सकता है, या क्लोरीन के चार परमाणुओं से। यह संयोजन विद्युत् संयोजन से भिन्न है। न तो कार्बन टेट्राक्लोराइड विलयनों में विभाजित होकर क्लोराइड आयन देता है और मेथेन विभाजित होकर हाइड्रोजन आयन। दो दो इलेक्ट्रॉनों के भागीदार बनने पर एक एक बंध बनता है। अत: कार्बन की सहसंयोजकता ४ है। कई कार्बन परमाणु भी सहसंयोजकताओं द्वारा आपस में उत्तरोत्तर क्रम से संयुक्त हो सकते हैं। इसी प्रकार साइक्लोपेंटेन, (C5H10), में ५ कार्बनों का बंद वलय और साइक्लोहेक्सेन, (C6H12), में ६ कार्बनों का बंद वलय है। कभी कभी अणुओं में असंतृप्त संयोजकताएँ होती हैं। यदि दो कार्बन परमाणुओं के बीच में ४ इलेक्ट्रॉनों की भागीदारी हो, तो कहा जाएगा कि इनके बीच में एक द्विबंध है और ६ इलेक्ट्रॉनों की भागीदारी हो तो कहेंगे कि इनके बीच में त्रिबंध हैं।
एकबंध (:) द्विबंध (::) की अपेक्षा और द्विबंध त्रिबंध (:::) की अपेक्षा अधिक प्रबल है। जिन यौगिकों में द्विबंध हैं, वे अधिक अस्थायी और अधिक असंतृप्त हैं। बेन्ज़ीन, (C6H6), बाद वलय का एक यौगिक है। इसमें तीन द्विबंध भी माने जा सकते हैं, पर यह विशेष रूप से स्थायी है। इसके प्रत्येक दो कार्बनों के बीच का एक बंध अनुनादी माना जाता है,[2] जिसके कारण बेंजीन वलय को विशेष स्थायित्व प्राप्त होता है।
इस प्रकार के अनुनादी गुणों के कारण ऐरोमैटिक नाभिक (जैसा बेन्ज़ीन में है) ऐलिफैटिक की अपेक्षा भिन्न समझे जाते हैं। कार्बनिक यौगिकों की विशेषता उनकी विस्तृत समावयता के कारण है। एक ही अणु के विभिन्न गुणवाले अनेक यौगिक होते हैं। साइक्लोप्रोपेन और प्रोपिलीन दोनों का एक ही अणु सूत्र (C3H6) है।
दिग्विन्यास समावयता के कारण् भी कार्बनिक यौगिकों में बहुत भिन्नता पाई जाती है। मलेइक अम्ल (सिस रूप) और फूमैरिक अम्ल (ट्रान्स रूप) में इसी कारण अंतर है। दोनों अम्लों के भौतिक और रासायनिक गुणों में अंतर है। लैक्टिक अम्ल, (CH3। CH. OH. COOH) NH2 में एक असममित कार्बन परमाणु है। जिस कार्बन की चार संयोजकताओं से भिन्न भिन्न मूलक संयुक्त हों, वह असममित कार्बन कहलाता है। जिन अणुओं में इस प्रकार के असममित कार्बन होंगे, वे विलयनों और क्रिस्टनों में प्रकाश-घूर्णन प्रदर्शित करते हैं। इनके अणु दक्षिण-भ्रामी (द-) और वामी भ्रामी (वा-) और निष्क्रिय तीनों रूपों में पाए जा सकते हैं। ८ ऐल्डोपेंटोस और १६ ऐल्डो-हेक्से की कल्पना ही प्रस्तुत नहीं की, उन्हें पृथक् करके उनका रचना विन्यास भी स्पष्ट कर दिया। ८ पेंटोस ये हैं : लिक्सोस, ज़ाइलो, ऐरेबिनोस और रिबोस और इन चारों के दक्षिणभ्रामी और वामभ्रामी दो दो रूप। ऐल्डोहेक्सोस में ४ असममित कार्बन हैं। अत: ये १६ प्रकार के होंगे। आठ दक्षिणभ्रामी और आठ वामभ्रामी (देखें कार्बोहाइड्रेट)।
अणुओं की रचना तीनों विमाओं में प्रसारित हैं, न केवल दो विमाओं के धरातल में। इन संरचनाओं में अनेक प्रकार की समावयवताएँ संभव हैं और कार्बनिक रसायन के अध्ययन में इन सबका महत्व है।
प्रकार्यात्मक समूह के आधार पर वर्गीकरण
नामकरण

सन्दर्भ
- ↑ Roberts, Laura (7 December 2010) History of Aspirin Archived 2014-10-08 at the वेबैक मशीन. The Telegraph
- ↑ Kiefer, D. M. (1993). "Organic Chemicals' Mauve Beginning". Chem. Eng. News. 71: 22–23. आइ॰एस॰एस॰एन॰ 0009-2347. डीओआइ:10.1021/cen-v071n032.p022.