कक्षीय संकरण

रासायनिकी में, लगभग समान ऊर्जा वाले पारमाण्विक कक्षकों के परस्पर मिलकर ऊर्जा के पुनर्वितरण द्वारा समान ऊर्जा तथा आकार वाले कक्षकों को बनाने की प्रक्रिया को कक्षीय संकरण (orbital hybridization) कहते हैं। बहुपारमाण्विक अणुवों की विशिष्ट भूमितीय आकृतियों को स्पष्ट करने हेतु पौलिङ ने परमाणु कक्षकों के संकरण का सिद्धान्त प्रस्तावित किया। इसके अनुसार परमाणु कक्षक संयोजित होकर समतुल्य कक्षकों का समूह बनाते हैं। इन कक्षकों को संकर कक्षक कहते हैं। आबन्ध विरचन (bond formation) में परमाणु शुद्ध कक्षकों के स्थान पर संकर कक्षकों का प्रयोग करते हैं। उदाहरणार्थ, कार्बन का एक 2s कक्षक तथा तीन 2p कक्षक संकरण द्वारा चार नूतन sp³ संकर कक्षक बनाते हैं।
लक्षण
- संकर कक्षकों की संख्या संकरण की प्रक्रिया में भाग लेने वाले कक्षकों को संख्या के समान होती है।
- संकर कक्षक सदैव समान ऊर्जा तथा आकार के होते हैं।
- संकर कक्षक स्थायी आबन्ध बनाने में शुद्ध कक्षकों की अपेक्षा अधिक सक्षम होते हैं।
- संकर कक्षक स्थायी व्यवस्था पाने हेतु त्रिविम में विशिष्ट दिशाओं में निर्देशित होते हैं। इसलिए संकरण का प्रकार आण्विक भूमिति दर्शाता है।
प्रकार
sp

sp संकरण में एक s तथा एक p कक्षक संकर होकर दो समान sp संकर कक्षकों का निर्माण करते हैं। z-अक्ष पर संकरण कक्षकों को पाने हेतु sp संकरण हेतु s तथा pz कक्षक उपयुक्त होते हैं। प्रत्येक कक्षक में 50% s-लक्षण तथा 50% p-लक्षण होता है। यदि संकर किसी अणु में केन्द्रीय परमाणु के संयोजक कक्ष के कक्षक sp संकर होते हैं तथा दो परमाण्वों से आबन्ध बनाते हैं, तो अणु की रैखिक भूमिति होती है। इस प्रकार के संकरण को विकर्ण संकरण भी कहते हैं।
sp संकर कक्षकों के दो उभरे हुए धनात्मक पालि तथा अत्यन्त छोटे ऋणात्मक पालि विपरीत दिशाओं में z-अक्ष की ओर दृष्ट होते हैं। इसके कारण प्रभावी अतिव्यापन होता है, जिसके फलस्वरूप प्रबलतर आबन्ध निर्मित होते हैं।
उदाहरण

BeCl2 (बेरिलियम ख्लोराइड) तलस्थावस्था में Be का वैद्युतिक विन्यास 1s²2s² होता है उत्तेजितावस्था में एक 2s इलेक्ट्रॉन रिक्त 2p कक्षक में Be की द्विसंयोजकता के कारण प्रोन्नत हो जाता है। एक 2s कक्षक तथा एक 2p कक्षक संकर होकर दो sp संकर कक्षक बनाते हैं जो 180° का कोण बनाते हैं। प्रत्येक sp संकर कक्षक Cl के 2p कक्षक से अक्षीय अतिव्यापन द्वारा दो Be-Cl सिग्माबन्ध बनाते हैं।

एथाइन (C2H2) अणु के निर्माण में दोनों कार्बन परमाणु sp संकरण दर्शाते हैं। उनपर दो असंकर (2px तथा 2py) कक्षक होते हैं।
एक कार्बन परमाणु का sp संकर कक्षक दूसरे कार्बन परमाणु के sp संकर कक्षक से अक्षीय अतिव्यापन द्वारा C-C सिग्माबन्ध बनाता है। बचे हुए संकर कक्षक हाइड्रोजन के अर्धभृत 1s कक्षकों से अक्ष द्वारा सिग्माबन्ध बनाते हैं। दोनों कार्बन परमाणु पर उपस्थित दो असंकर कक्षक पार्श्वातिव्यापन द्वारा दो Π आबन्ध बनाते हैं। इस प्रकार एथाइन में दो कार्बन परमाण्वों के मध्यस्थित त्र्याबन्ध एक सिग्मा तथा दो π आबन्धों से बना होता है।
sp²

sp² संकरण में एक s कक्षक तथा दो p कक्षक संकर होकर तीन समान sp² संकर कक्षकों का निर्माण करते हैं।
उदाहरण
BCl3 (बोरोन ट्राइफ्लोराइड) के अणु में केन्द्रीय बोरॉन परमाणु की तलस्थावस्था विन्यास 1s²2s² 2p¹ होता है। उत्तेजितावस्था में एक 2s इलेक्ट्रॉन रिक्त 2p कक्षक में प्रोन्नत हो जाता है, जिसके फलस्वरूप बोरॉन में तीन एकल इलेक्ट्रॉन उपस्थित होते हैं। तीन (एक 2s तथा दो 2p) कक्षक संकर होकर तीन sp² संकर कक्षक बनाते हैं। तीन संकर कक्षक त्रिकोणीय समतली व्यवस्था में होते हैं तथा Cl परमाणुओं के 2p कक्षकों से अतिव्यापन द्वारा तीन BCl आबन्ध बनाते हैं। इसलिए BCl अणु की त्रिकोणीय समतली भूमिति होती है, जिसमें Cl-B-Cl आबन्ध कोण 120° का होता है।
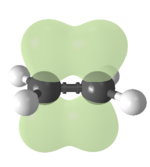
एथीन (C2H4) में sp संकरण अणु के निर्माण में कार्बन परमाणु का एक sp² संकर कक्षक से अक्षीय अतिव्यापन द्वारा C-C सिग्माबन्ध बनाता है, जबकि प्रत्येक कार्बन परमाणु के अन्य दो sp संकर कक्षक हाइड्रोजन परमाण्वों के साथ sp² सिग्माबन्ध बनाते हैं। एक कार्बन परमाणु का असंकर कक्षक 2px अथवा 2py दूसरे कार्बन परमाणु के समान कक्षक के साथ पार्श्वातिव्यापन द्वारा दुर्बल आबन्ध बनाता है जिसमें कार्बन तथा हाइड्रोजन परमाण्वों के तल के ऊपर तथा नीचे समान इलेक्ट्रॉन अभ्र होता है।
इस प्रकार एथीन अणु में C-C के मध्य एक sp²-sp² संकर कक्षकों में सिग्माबन्ध तथा एक π आबन्ध (जिसकी दैर्घ्य 134 pm होती है, जो p-कक्षकों के मध्य होता है) संकरण में प्रयोग नहीं होते एवं अणु के तल के लम्बवत् होते हैं। C-H आबन्ध में (sp²-s) सिग्माबन्ध की दैर्घ्य 108 pm होती है एवं H-C-H एवं H-C-C के आबन्ध कोण क्रमश: 117.6° और 121° होते हैं।
sp³

sp³ संकरण की व्याख्या मेथेन (CH4), अणु के उदाहरण द्वारा की जा सकती है। इसमें सहसंयोजक कक्ष के एक s कक्षक तथा तीन p कक्षकों के संकरण से चार sp³ संकर कक्षक बनते हैं। ये कक्षक समान ऊर्जा तथा आकार के होते हैं। प्रत्येक sp कक्षक में 25% s-लक्षण तथा 75% p-लक्षण होता है। sp संकरण द्वारा प्राप्त चार sp³ संकर कक्षक चतुष्फलक के चार कोणों की ओर होते हैं, तथा संकर कक्षकों के मध्यस्थित कोण का मान 109.5° होता है।

जल (H2O) के अणु में ऑक्सिजन परमाणु के चार संयोजक कक्ष, कक्षक (एक 2s तथा तीन 2p) sp³ संकरण द्वारा चार sp³ संकर कक्षक बनाते हैं। इनमें से दो संकर कक्षकों में एक युग्म होता है। ये चार sp³ संकर कक्षक चतुष्फलकीय भूमिति प्राप्त करते हैं, जिसमें दो कोणों पर हाइड्रोजन परमाणु आबन्धित होते हैं तथा अन्य दो कोणों पर एकाकी इलेक्ट्रॉन युग्म उपस्थित होते हैं। इस अणु में आबन्ध कोण 109.5° से घटकर 104.5° हो जाता है शतथा अणु V-आकृति अथवा कोणीय ज्यामिति ग्रहण करता है।

अमोनिया (NH3) में नाइट्रोजन परमाणु का तलस्थावस्था वैद्युतिक विन्यास 2s¹2px¹2py¹2pz¹ होता है। sp³ संकर कक्षकों में तीन sp³ संकर कक्षकों में अयुग्मित इलेक्ट्रॉन होता है, जबकि चतुर्थ sp³ संकर में एक एकाकी इलेक्ट्रॉन युग्म होता है। नाइट्रोजन के तीन sp³ संकर कक्षक तीन हाइड्रोजन परमाण्वों के 1s कक्षकों के साथ अतिव्यापन द्वारा तीन NH3 आबन्ध निर्मित करते हैं। एकाकी युग्म तथा आबन्धित युग्म के बीच आबन्धित युग्म की अपेक्षा प्रतिकर्षण आबंधी युग्म अधिक होता है। इसके फलस्वरूप NH3 के अणु में आबन्ध कोण 109.5° से घटकर 107° हो जाता है जिससे आण्विक भूमिति विकृत होकर पिरामिडीय हो जाती है।
एथेन के अणु में कार्बन के दोनों कार्बन sp³ संकर होते हैं। कार्बन परमाणु के चार sp³ संकर कक्षकों में परमाणु से एक, अन्य कार्बन परमाणु के एक sp³ संकर कक्षक से अक्षीय अतिव्यापन द्वारा sp³-sp³ सिग्माबन्ध बनाते हैं, जबकि प्रत्येक कार्बन परमाणु के अन्य तीन संकर कक्षक हाइड्रोजन परमाण्वों के 1s कक्षकों के साथ sp³-s सिग्मा आबन्ध बनाते हैं। इसके फलस्वरूप एथेन C-C आबन्ध दैर्घ्य 154 pm और C-H आबन्ध दैर्घ्य 109 pm होती है।