आवर्त सारणी

रासायनिक तत्त्वों की आवर्त सारणी रासायनिक तत्त्वों को उनकी संगत विशेषताओं के साथ एक सारणी के रूप में दर्शाने की एक व्यवस्था है। आवर्त सारणी में रासायनिक तत्त्व परमाणु क्रमांक के आरोही क्रम में सुसज्जित हैं तथा आवर्त, प्राथमिक समूह, द्वितीयक समूह में वर्गीकृत किया गया है। वर्तमान आवर्त सारणी मैं ११८ ज्ञात तत्व सम्मिलित हैं। रूसी रसायनज्ञ द्मित्री मिन्दिलेयिफ़ तथा जर्मन रसायनज्ञ लोथार मायर के सतत प्रयासों के फलस्वरूप आवर्त सारणी के विकास में साफल्य प्राप्त हुई । स्वतन्त्र रूप से कार्य करते हुए दोनों रसायनज्ञों ने सन् 1869 में प्रस्तावित किया कि जब तत्त्वों को उनके परमाणु द्रव्यमानों के आरोही क्रम में व्यवस्थित किया जाता है, तब नियमित अन्तराल के पश्चात् उनके भौतिक तथा रासायनिक गुणों में समानता पाई जाती है। मायर ने भौतिक गुणों जैसे पारमाण्विक आयतन, गलनांक एवं क्वथनांक और परमाणु द्रव्यमान के मध्य वक्र आलेखित किया, जो एक निश्चित समुच्चय वाले तत्त्वों में समानता दर्शाता था। सन् 1868 तक मायर ने तत्त्वों की एक सारणी का विकास कर लिया, जो आधुनिक आवर्त सारणी से काफी मिलती थी, किन्तु उसके कार्य का विवरण मिन्दिलेयिफ़ के कार्य के विवरण से पूर्व प्रकाशित नहीं हो पाया। आधुनिक आवर्त सारणी के विकास में योगदान का श्रेय मिन्दिलेयिफ़ को दिया गया है।
रसायन शास्त्र में आवर्त सारणी का अत्यन्त महत्त्व एवं उपयोग है। इसके कारण कम तत्त्वों के गुणधर्मों को ही स्मरण रखने से काम चल जाता है क्योंकि आवर्त सारणी में किसी समूह (उर्ध्वाधर पंक्ति) या किसी आवर्त (क्षैतिज पंक्ति) में गुणधर्म एक निश्चित क्रम से एवं तर्कसम्मत तरीके से बदलते हैं। नीचे आवर्त सारणी का आधुनिक रूप दिखाया गया है जिसमें १८ वर्ग तथा ७ आवर्त हैं-
| समूह → | १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० | ११ | १२ | १३ | १४ | १५ | १६ | १७ | १८ | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ आवर्त | |||||||||||||||||||||
| ० | ० / | ||||||||||||||||||||
| १ | १ H | २ He | |||||||||||||||||||
| २ | ३ Li | ४ Be | ५ B | ६ C | ७ N | ८ O | ९ F | १० Ne | |||||||||||||
| ३ | ११ Na | १२ Mg | १३ Al | १४ Si | १५ P | १६ S | १७ Cl | १८ Ar | |||||||||||||
| ४ | १९ K | २० Ca | २१ Sc | २२ Ti | २३ V | २४ Cr | २५ Mn | २६ Fe | २७ Co | २८ Ni | २९ Cu | ३० Zn | ३१ Ga | ३२ Ge | ३३ As | ३४ Se | ३५ Br | ३६ Kr | |||
| ५ | ३७ Rb | ३८ Sr | ३९ Y | ४० Zr | ४१ Nb | ४२ Mo | ४३ Tc | ४४ Ru | ४५ Rh | ४६ Pd | ४७ Ag | ४८ Cd | ४९ In | ५० Sn | ५१ Sb | ५२ Te | ५३ I | ५४ Xe | |||
| ६ | ५५ Cs | ५६ Ba | * | ७२ Hf | ७३ Ta | ७४ W | ७५ Re | ७६ Os | ७७ Ir | ७८ Pt | ७९ Au | ८० Hg | ८१ Tl | ८२ Pb | ८३ Bi | ८४ Po | ८५ At | ८६ Rn | |||
| ७ | ८७ Fr | ८८ Ra | ** | १०४ Rf | १०५ Db | १०६ Sg | १०७ Bh | १०८ Hs | १०९ Mt | ११० Ds | १११ Rg | ११२ Cn | ११३ Nh | ११४ Fl | ११५ Mc | ११६ Lv | ११७ Ts | ११८ Og | |||
| ८ | ११९ Uue | १२० Ubn | *** | ||||||||||||||||||
| * लैन्थनाइड | ५७ La | ५८ Ce | ५९ Pr | ६० Nd | ६१ Pm | ६२ Sm | ६३ Eu | ६४ Gd | ६५ Tb | ६६ Dy | ६७ Ho | ६८ Er | ६९ Tm | ७० Yb | ७१ Lu | ||||||
| ** ऐक्टिनाइड | ८९ Ac | ९० Th | ९१ Pa | ९२ U | ९३ Np | ९४ Pu | ९५ Am | ९६ Cm | ९७ Bk | ९८ Cf | ९९ Es | १०० Fm | १०१ Md | १०२ No | १०३ Lr | ||||||
| *** महालैन्थनाइड | १२१ Ubu | १२२ Ubb | १२३ Ubt | १२४ Ubq | १२५ Ubp | १२६ Ubh | १२७ Ubs | १२८ Ubo | १२९ Ube | १३० Utn | १३१ Utu | १३२ Utb | १३३ Utt | १३४ Utq | १३५ Utp | १३६ Uth | १३७ Uts | १३८ Uto | |||
आवर्त सारणी के इस प्रचलित प्रबन्ध में लैन्थनाइड और ऐक्टिनाइड को अन्य धातुओं से अलग रखा गया है। विस्तृत और अति-विस्तृत आवर्त सारणीओं में एफ़-खण्ड और जी-खण्ड धातुओं को भी एक साथ प्रबन्धित किया जाता है।
|
| |||||||
प्रमुख विशेषताएँ
तत्त्वों के परमाणु द्रव्यमान के वृद्धि क्रम में क्रमबद्ध करने पर क्षैतिज पंक्तियाँ प्राप्त होती हैं जिन्हें 'आवर्त' कहते हैं। आवर्त नियमानुसार आवर्तों सामन गुण वाले तत्त्व एक ही उर्ध्वाधर स्तम्भ में उपस्थित रहते हैं, इन्हें 'वर्ग' कहते हैं।
आवर्त सारणी के उर्ध्व स्तम्भों को 'समूह' या 'वर्ग' कहा जाता है। तत्वों के वर्गीकरण की दृष्टि से समूहों को सबसे महत्त्वपूर्ण माना जाता है। कुछ समूहों में, तत्त्व समान गुण दर्शाते हैं। इन समूहों के नाम क्षारीय धातु, क्षारीय पार्थिव धातु, हैलोजन, निक्टोजन, खाल्कोजन और उत्कृष्ट तत्त्व। यद्यपि तत्वों के वर्गीकरण में वर्ग अधिक महत्त्वपूर्ण माने जाते हैं, तथापि आवर्त सारणी में कई स्थल ऐसे होते हैं जहाँ आवर्त का महत्त्व अधिक हो जाता है। उदाहरणार्थ d-खण्ड या संक्रमण धातुओं और f-खण्ड या आन्तरिक संक्रमण ततवत्वों को लिया जा सकता है।
वर्ग
एक ही वर्ग में उपस्थित तत्त्वों के संयोजक कोश वैद्युतिक विन्यास समान होते हैं। इनके बाह्य कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या एवं गुणधर्म भी समान होते हैं। उदाहरणार्थ वर्ग 1 के तत्त्वों (क्षार धातुओं) का संयोजक कोश का वैद्युतिक विन्यास ns¹ होता है,
- हल्की धातुएँ
- क्षारीय धातुएँ- वर्ग 1
- क्षारीय पार्थिव धातुएँ- वर्ग 2
- संक्रमण धातुएँ - वर्ग 3, 4, 5, 6, 7, 8, 9, 10, 11 और 12
- अधातुएँ- वर्ग 13, 14, 15, 16 और 17
- उत्कृष्ट तत्त्व- वर्ग 18
खण्ड

संयोजक इलेक्ट्रानों के आधार पर तत्वों को 4 खण्डों में विभक्त गया है- s, p, d, f।
- s-खण्ड – वर्ग 1 तथा 2
- p-खण्ड – वर्ग 13 से 18
- d-खण्ड – वर्ग 3 से 12
- f-खण्ड – लैन्थेनॉइड और ऐक्टिनॉइड
- मुख्य-वर्ग तत्त्व: s-खण्ड और p-खण्ड के तत्वों को सम्मिलित रूप से
- संक्रमण तत्त्व: d-खण्ड के तत्त्व
- आन्तरिक संक्रमण तत्त्व: f-खण्ड के तत्त्व।
आवर्त
- प्रथम आवर्त में केवल 2 तत्त्व हैं, यह सबसे छोटा आवर्त है।
- द्वितीय और तृतीय आवर्त में आठ तत्त्व हैं। इन्हें 'लघु आवर्त' कहते हैं।
- चतुर्थ और पंचम आवर्त में 18 तत्त्व हैं। इन्हें 'दीर्घ आवर्त' कहते हैं।
- षष्ठ और सप्तम आवर्त में 32 तत्त्व हैं। यह सबसे बड़े आवर्त हैं।
- षष्ठ आवर्त के तृतीय वर्ग में परमाणु क्रमांक 57 से 71 तक के तत्त्व हैं। इन्हें 'लैन्थेनॉइड' कहते हैं।
- सप्तम आवर्त के तृतीय वर्ग में परमाणु क्रमांक 89 से 103 वाले तत्त्व हैं। इन्हें ऐक्टिनॉइड कहते हैं।
गुणधर्मों में आवर्तिता
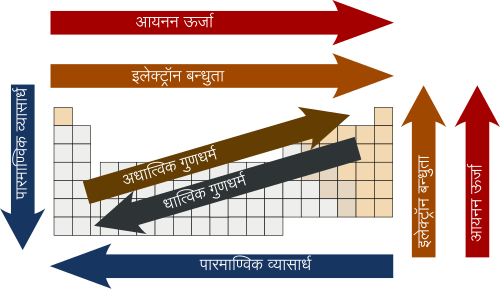
इतिहास


सबसे पहले रूसी रसायन-शास्त्री मेंडलीफ ने सन १८६९ में आवर्त नियम प्रस्तुत किया और तत्वों को एक सारणी के रूप में प्रस्तुत किया। इसके अनुसार,
- तत्वों के भौतिक और रासायनिक गुण उनके परमाणुभारों के आवर्तफलन होते हैं
अर्थात् यदि तत्वों को परमाणु भार के वृद्धिक्रम में रखा जाय तो वो तत्त्व जिनके गुण समान होते हैं एक निश्चित अवधि के बाद आते हैं। मेंडलीव ने इस सारणी के सहारे तत्वों के भौतिक एवं रासायनिक गुणों के आवर्ती होने के पहलू को प्रदर्शित करने का प्रयत्न किया।
मैंडलीफ की आवर्त सारणी में कुल ८ वर्ग थे क्योंकि उस समय निष्क्रिय गैसों की खोज नहीं हुई थी। बाद में निष्क्रिय गैसों की खोज के पश्चात आधुनिक आवर्त सारणी में ९वें वर्ग को सम्मिलित किया गया। इस ९वें वर्ग को ० (शून्य वर्ग) कहते हैं। वर्ग एक से आठवें वर्ग को रोमन अक्षर I, II, III, IV, V, VI, VII तथा VIII द्वारा प्रदर्शित किया जाता है। नवें वर्ग को ० द्वारा प्रदर्शित किया जाता है।[1] इसके विकास के अंतिम चरण में राग, वर्नर, बोहर और बरी आदि वैज्ञानिकों ने आवर्त सारणी का आधुनिकतम रूप बनाया जो वर्तमान तक चलन में है। इन्होंने मेंडेलिव की आवर्त सारणी में उपस्थित श्रेणियों को खत्म किया तथा वर्गो की संख्या को ९ से बढ़ाकर १८ किया। इसके बाद भी हाइड्रोजन का दो स्थानों पर होना और लेंथेनाइड और एक्टीनाइड तत्वों को सारणी में स्थान न होना दो मुख्य दोष अब तक हैं।
मेडलीफ द्वारा आवर्त सारणी प्रस्तुत करने के कुछ महीनों बाद जर्मन वैज्ञानिक लोथर मेयर (1830-1895) ने भी स्वतन्त्र रूप से आवर्त सारणी का निर्माण किया। १८१५ से १९१३ तक इसमें बहुत से सुधार हुए ताकि नये आविष्कृत तत्वों को उचित स्थान दिया जा सके और सारणी नई जानकारियों के अनुरूप हो।
मेन्देलेयेव की सारणी से अल्फ्रेड वर्नर (Alfred Werner) ने आवर्त सारणी का वर्तमान स्वरूप निर्मित किया। सन १९५२ में कोस्टा रिका के वैज्ञानिक गिल चावेरी (scientist Gil Chaverri ) ने आवर्त सारणी का एक नया रूप प्रस्तुत किया जो तत्वों के इलेक्ट्रानिक संरचना पर आधारित था।
आवर्त सारणी के अन्य रूप
 |  |
सन्दर्भ
- ↑ प्रसाद, चन्द्रमोहन (जुलाई २००४). भौतिक एवं रसायन विज्ञान. कोलकाता: भारती सदन. पृ॰ 211. अभिगमन तिथि 2 जून २००९.
