अमोनिया
| अमोनिया | |
|---|---|
 |  |
 | |
| आईयूपीएसी नाम | Azane |
| अन्य नाम | Hydrogen nitride Trihydrogen nitride |
| पहचान आइडेन्टिफायर्स | |
| सी.ए.एस संख्या | [7664-41-7][CAS] |
| पबकैम | |
| EC संख्या | |
| UN संख्या | 1005 |
| केईजीजी | D02916 |
| MeSH | Ammonia |
| रासा.ई.बी.आई | 16134 |
| RTECS number | BO0875000 |
| SMILES | |
| InChI | |
| 3587154 | |
| जी-मेलिन संदर्भ | 79 |
| कैमस्पाइडर आई.डी | |
| 3DMet | {{{3DMet}}} |
| गुण | |
| आण्विक सूत्र | NH3 |
| मोलर द्रव्यमान | 17.031 g/mol |
| दिखावट | Colourless gas |
| गंध | strong pungent odour |
| घनत्व | 0.86 kg/m3 (1.013 bar at boiling point) 0.769 kg/m3 (STP)[1] |
| गलनांक | −77.73 °C, 195 K, -108 °F |
| क्वथनांक | −33.34 °C, 240 K, -28 °F |
| जल में घुलनशीलता | 47% w/w (0 °C) 31% w/w (25 °C) 18% w/w (50 °C)[4] |
| घुलनशीलता | soluble in chloroform, ether, ethanol, methanol |
| वाष्प दबाव | 8573 h Pa |
| अम्लता (pKa) | 32.5 (−33 °C),[5] 10.5 (DMSO) |
| Basicity (pKb) | 4.75 |
| रिफ्रेक्टिव इंडेक्स (nD) | 1.3327 |
| श्यानता | 0.276 cP (−40 °C) |
| ढांचा | |
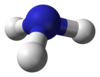
| आण्विक आकार | Trigonal pyramid |
| Dipole moment | 1.42 D |
| Thermochemistry | |
| फॉर्मेशन की मानक एन्थाल्पीΔfH | −46 kJ·mol−1[6] |
| मानक मोलीय एन्ट्रॉपी S | 193 J·mol−1·K−1[6] |
| खतरा | |
| EU वर्गीकरण | साँचा:Hazchem T |
| NFPA 704 |  1 3 0 |
| R-फ्रेसेज़ | साँचा:R10, साँचा:R23, R34, साँचा:R50 |
| S-फ्रेसेज़ | (S1/2), S9, S16, S26, साँचा:S36/37/39, S45, S61 |
| स्फुरांक (फ्लैश पॉइन्ट) | flammable gas |
| Explosive limits | 15–28% |
| यू.एस अनुज्ञेय अवस्थिति सीमा (पी.ई.एल) | 50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) |
| एलडी५० | 0.015 mL/kg (human, oral) |
| Related compounds | |
| Other cations | Phosphine Arsine Stibine |
| जहां दिया है वहां के अलावा, ये आंकड़े पदार्थ की मानक स्थिति (२५ °से, १०० कि.पा के अनुसार हैं। | |
अमोनिया एक तीक्ष्म गंध वाली रंगहीन गैस है। यह हवा से हल्की होती है तथा इसका वाष्प घनत्व ८.५ है। यह जल में अति विलेय है। अमोनिया के जलीय घोल को लिकर अमोनिया कहा जाता है यह क्षारीय प्रकृति का होता है। जोसेफ प्रिस्टले ने सर्वप्रथम अमोनियम क्लोराइड को चूने के साथ गर्म करके अमोनिया गैस को तैयार किया। बर्थेलाट ने इसके रासायनिक गठन का अध्ययन किया तथा इसको बनाने वाले तत्वों को पता लगाया। प्रयोगशाला में अमोनियम क्लोराइड तथा बुझे हुए सूखे चूने के मिश्रण को गर्म करके अमोनिया गैस तैयार की जाती है।
उपयोग
यूरिया, अमोनियम सल्फेट, अमोनियम फास्फेट, अमोनियम नाइट्रेट आदि रासायनिक खादों को बनाने में अमोनिया का उपयोग किया जाता है। बड़े पैमाने पर नाइट्रिक एसिड तथा सोडियम कार्बोनेट के निर्माण में इसका उपयोग किया जाता है। बर्फ बनाने के कारखाने में शीतलीकारक के रूप में अमोनिया का उपयोग किया जाता है। प्रयोगशाला में प्रतिकारक के रूप में इसका उपयोग किया जाता है। लिकर अमोनिया का उपयोग कपड़ों से तेल ग्रीज आदि के दाग को छुड़ाने के लिए किया जाता है। अमोनियम कार्बोनेट बनाने में इसका उपयोग किया जाता है। अपने अत्यधिक उपयोग के कारण पूरी दुनिया में इसका व्यापक पैमाने पर उत्पादन होता है। २००४ में पूरे विश्व में इसका आनुमानिक उत्पादन १० करोड़ ९० लाख टन हुआ था।[7] २००६ में इसका उत्पादन लगभग १४ करोड़ ६५ लाख टन हुआ है।[8] अमोनिया उत्पादन में भारत का स्थान चीन के बाद द्वितीय है। ये दोनों देश विश्व उत्पादन का क्रमशः २८.४% तथा ८.६% उत्पादित करते हैं। रूस ८.४% तथा संयुक्त राज्य अमेरिका ८.२% के उत्पादन के साथ तीसरे और चौथे स्थान पर हैं।[7] कुल उत्पादन के ८०% का उपयोग उर्वरक बनाने के लिए होता है।[7] नाइट्रीकरण की प्रक्रिया द्वारा कुछ सजीवों में वायुमंडलीय नाइट्रोजन से अमोनिया का निर्माण होता है।
किसी उद्योग या अमोनिया टैंक से अमोनिया का रिसाव होकर यदि अचानक अमोनिया वातावरण में फैल जाए तो आँख तथा चेहरे को काफी अधिक पानी के द्वारा धोना चाहिए। अमोनिया जल में अति विलेय है इसलिए चेहरे को जल से धोने से यह घुलकर अलग हो जाती है।
सन्दर्भ
- ↑ "संग्रहीत प्रति". मूल से 18 मार्च 2016 को पुरालेखित. अभिगमन तिथि 13 जनवरी 2016.
- ↑ Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. पृ॰ 132. आई॰ऍस॰बी॰ऍन॰ 1-4067-7302-6.
- ↑ Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids. 24 (4): 277. डीओआइ:10.1080/00337577508240819.
- ↑ Budavari, Susan, संपा॰ (1996). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th संस्करण). Merck. आई॰ऍस॰बी॰ऍन॰ 0-911910-12-3.
- ↑ Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.
- ↑ अ आ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. पृ॰ A22. आई॰ऍस॰बी॰ऍन॰ 0-618-94690-X.
- ↑ अ आ इ "United States Geological Survey publication" (PDF). मूल से 16 दिसंबर 2008 को पुरालेखित (PDF). अभिगमन तिथि 17 जनवरी 2009.
- ↑ Max Appl "Ammonia" in Ullmann's Encyclopedia of Industrial Chemistry, 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_143.pub2 Article Online Posting Date: December 15, 2006
